CAPITULO 3VENTILACION E INTERCAMBIO GASEOSO |
|
|
Estas diferencias se deben a diversas razones: Si bien la ventilación alveolar es determinada tanto por las demandas de captación de O2 como por las de eliminación de CO2, su ajuste es mucho más estrecho en relación con este último gas. Ello se debe a que el nivel de CO2 en la sangre debe mantenerse rigurosamente controlado por su participación en equilibrios biológicos muy finos como el ácido básico, isoeléctrico y osmótico. El control del nivel de oxígeno arterial, en cambio, tiene una mayor flexibilidad, ya que una vez que se supera el nivel crítico de 60 mmHg. los cambios de presión alveolar de este gas pesan poco sobre la cantidad de oxígeno que transporta la sangre arterial, fenómeno ligado a las propiedades de la hemoglobina, como veremos más adelante. El aire espirado es la mezcla del aire alveolar que participó en la hematosis y el aire atmosférico que quedó en el espacio muerto en la inspiración anterior. Respecto al aire inspirado el oxigeno ha bajado a un 14-15 % y el CO2 ha subido considerablemente a un 4 %. Presión alveolar de CO2 (PACO2)La ventilación alveolar normal se define como aquella capaz de mantener la presión alveolar de CO2 (PACO2) dentro de los límites normales de 35 a 45 mmHg. La PACO2
depende del balance entre su producción por el organismo
(
De ella se deduce que,
en condiciones metabólicas estables, el aumento de ventilación
alveolar conduce a una disminución de PACO2
y la disminución de 
El equilibrio de la PCO2
entre alvéolo y sangre es tan rápido y completo
que la presión arterial de CO2 corresponde
a la PACO2 media, característica
que facilita marcadamente la evaluación de la ventilación
alveolar en clínica. Hay que tener presente que
la interpretación de este indicador debe hacerse siempre
en relación al cuadro clínico del paciente, ya
que, por ejemplo, una Presión alveolar de O2 (PAO2)La PAO2 está determinada por el equilibrio entre el consumo de O2 del organismo y el aporte de la ventilación (Fig. 3-1). Este último depende básicamente de la presión parcial de O2 en el aire inspirado y, como ésta depende de la presión barométrica, la PaO2 "normal" es diferente según la altitud del lugar donde se realiza la medición. A diferencia de lo que sucede con el CO2, la presión arterial de O2 no es igual a la alveolar, por razones que veremos más adelante. La obtención de muestras de aire alveolar para análisis es un proceso complejo, justificado para el área de la investigación, por lo que en clínica la PAO2 se calcula usualmente mediante la ecuación del aire alveolar, que en su forma simplificada se expresa en la siguiente forma: PAO2 = PIO2 - ( PaCO2 / QR) De esta ecuación conviene destacar lo siguiente: •La PIO2 es la presión inspirada de oxígeno que se calcula con la siguiente fórmula: PIO2 = (PB - 47) FIO2 La presión total del aire inspirado es igual a la presión atmosférica o barométrica (PB). Si se le resta 47 mmHg, que es la presión producida por el vapor de agua una vez que el aire ha sido saturado y calentado a 37°C en la nariz y vía aérea alta, se tiene la presión total de aire inspirado seco. Al multiplicar esta presión por la fracción que el O2 representa en el aire seco (0,2094 o 20,94%) se obtiene la presión parcial de O2. La Tabla 3-2 muestra la PB y la PIO2 a diferentes altitudes.
La PaCO2
es igual, como ya se dijo, a la PACO2 media.
Como el CO2 llega por los capilares directamente al
alvéolo, ocupa en ellos un espacio que limita la entrada
de O2, por lo cual debe restarse a la presión
inspirada de O2.
El cuociente respiratorio (QR = Como en la aplicación de esta fórmula usualmente no se mide la presión barométrica, sino que se usa la mas frecuente en la localidad, y el cuociente respiratorio es ordinariamente presumido como 0,8 los resultados deben estimarse sólo como aproximaciones, suficientes para el uso clínico, lo que significa que en su interpretación no deben considerarse variaciones de unos pocos milímetros. Algunos ejemplos permitirán comprender mejor el significado y aplicación de esta ecuación
DIFUSION O TRANSFERENCIA DE GASESUna vez que la ventilación ha asegurado en el alvéolo una presión parcial de O2 superior a la de la sangre venosa que llega al capilar pulmonar y una presión parcial de CO2 inferior a la de la sangre venosa, se producen los gradientes necesarios para el correspondiente movimiento o difusión de moléculas gaseosas a través de la membrana alvéolo-capilar. Los principales factores que influyen en este fenómeno están definidos por la ley de Fick: En esta ecuación, Diferencia de presiones parciales de los gases entre alvéolo y capilar. La PAO2 en Santiago es de aproximadamente 90 mmHg y la PvO2 de la sangre venosa es de alrededor de 40 mmHg, de manera que al comienzo del capilar pulmonar existe un gradiente de 50 mmHg que permite una rápida difusión inicial de este gas. A medida que pasa el O2 del alvéolo a la sangre, el gradiente disminuye gradualmente hasta llegar a ser de 1 mmHg o menos al final del capilar. Por otra parte, la PACO2 es de 40 mmHg y la de la sangre venosa de 46 mmHg, por lo que existe un gradiente inicial de 6 mmHg hacia el alvéolo. Dada la alta difusibilidad del CO2 esta diferencia es más que suficiente para que el exceso de CO2 venoso difunda rápida y totalmente. Solubilidad y peso molecular de los gases. La difusión de un gas a través del líquido de la membrana alveolar depende directamente de la solubilidad del gas en el agua y es inversamente proporcional a la raíz cuadrada de su peso molecular. En la práctica, esto significa que el CO2 difunde cerca de 20 veces más rápidamente que el O2, porque posee una mayor solubilidad , lo que explica que los trastornos de difusión prácticamente no modifiquen la PaCO2. También es parte del proceso de difusión el paso del gas desde la membrana alvéolo-capilar al plasma y al interior del glóbulo rojo, en el caso del oxígeno, y el proceso inverso , en el caso del CO2, lo que significa que los gases no sólo deben atravesar las capas previamente mencionadas, sino también el plasma y la membrana del eritrocito. En este fenómeno de transferencia tiene importancia el tiempo de contacto aire-sangre. Normalmente, un eritrocito demora alrededor de 0,7 segundos en atravesar la porción del capilar que se halla en contacto con el aire alveolar. Este tiempo involucra un amplio margen de seguridad, ya que el equilibrio completo entre aire y sangre se alcanza en aproximadamente 0,3 segundos para el oxígeno y es aun más rápido para el CO2. Si la velocidad de la sangre aumenta, como sucede en el ejercicio, el margen de seguridad se reduce pero, en sujetos normales, no se alcanzan a producir problemas. En cambio, si existen anomalías que demoren la difusión, la aceleración del flujo sanguíneo capilar acentúa o hace aparecer la hipoxemia o disminución de la PaO2. Esta característica se aprovecha en clínica para detectar anomalías de difusión mediante el ejercicio. (Fig. 3-2) . 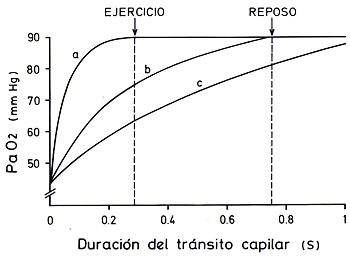
Evaluación de la difusiónPara valorar la difusión de un gas a través de una membrana se puede utilizar la medición de la capacidad de difusión, definida como la cantidad de gas que es transferida por unidad de tiempo, por cada unidad de diferencia de presión de ese gas entre ambos lados de la membrana. Cuando se mide la capacidad de difusión del oxígeno para el pulmón en globo se está midiendo no sólo la difusión propiamente tal, sino que el efecto de otros factores como son el área total de la membrana de intercambio, la relación ventilación-perfusión, la cantidad de hemoglobina de la sangre y el débito cardíaco. Algunos investigadores prefieren usar la denominación de "factor de trasferencia" que refleja mejor la multifactoriedad del proceso medido.Con el propósito de eliminar la influencia de la cantidad de hemoglobina y perfusión alveolar se utiliza la medición de la capacidad de difusión del monóxido de carbono (DLCO). Como la concentración de monóxido que se usa es muy baja y este gas tiene una afinidad por la hemoglobina 200 veces mayor que la del oxígeno, en ninguna circunstancia la capacidad de captación de CO de la sangre llega a constituir una limitante para el proceso de transferencia. Si hay sangre dentro de los alvéolos o existen hemoglobinas anómalas la medición resulta inexacta. Una disminución de la DLCO también puede ser causada por disminución del área total de membrana, aunque sus características estructurales permanezcan normales. Por estas razones, este examen es muy sensible para detectar alteraciones de la transferencia de gases a través del pulmón, pero no permite asegurar que la difusión propiamente tal sea el único factor causal del trastorno. Dado que en condiciones patológicas es prácticamente imposible que la difusión en sí misma se altere aisladamente, la medición de la capacidad de difusión, se mide simultáneamente el volumen alveolar y se calcula la cantidad de CO transferido por cada litro de volumen alveolar. .Una estimación más exacta de las alteraciones de difusión propiamente tales puede obtenerse con la técnica de eliminación de gases inertes múltiples, paro esta sólo tiene aplicación dentro del campo de la investigación. RELACIONES VENTILACION-PERFUSIONAun cuando la ventilación
y la difusión sean normales, el intercambio gaseoso no
puede llevarse a cabo de una manera eficiente si no existe una
adecuado contacto y determinada proporcionalidad entre la ventilación
y la perfusión de los alvéolos..Esta característica
es denominada relacione ventilación-perfusión( Dado que en condiciones
normales el pulmón ventila sus alvéolos con 4 L/min
y éstos reciben un flujo cardiaco de 5 L/min, puede deducirse
que la relación global adecuada es del orden de 4/5 o 0,8.
Esto no significa que todos los territorios alveolares tengan
esta misma relación Los territorios alveolares
pueden agruparse en tres compartimentos según el
tipo de
Aunque la denominación
de compartimentos es muy difundida estas categorías
no son realmente entidades físicamente delimitadas sino,
mas bien, son áreas de una curva continua de distribución
de los alvéolos que va desde 
En sujetos normales en posición vertical la presión dentro de los vasos sanguíneos es mayor en las bases que en los vértices debido al peso de la columna de sangre por lo que el flujo sanguíneo pulmonar disminuye progresivamente desde las bases hacia los vértices, donde casi no hay perfusión. En decúbito dorsal se establece una diferencia similar, aunque de grado menor, entre la zona dorsal y la ventral. Como la presión intraalveolar es prácticamente igual en todo el pulmón, la relación entre ésta y la presión intracapilar varía en diferentes zonas. En posición vertical la ventilación alveolar también disminuye desde la base hacia el vértice, pero la magnitud del cambio es mucho menor que el de la perfusión. Esto se debe a que el peso del pulmón gravita sobre las bases .determinando que la presión pleural en éstas sea menos negativa que en los vértices. En consecuencia al comienzo de una inspiración normal la presión transpulmonar en el vértice es alrededor de 10 cmH2O y en la base sólo de 2,5 cm H2O. Esto significa que los alvéolos de la base están menos distendidos que los del vértice por lo cual pueden expandir mas y captar mas del aire que se inspira. Por otra parte, como la curva de presión-volumen no es lineal y tiende a la horizontalidad en su porción superior, los alvéolos del vértice, por tener un mayor volumen inicial, están en un nivel de menor distensibilidad que los de la base y expandirán menos ante un mismo cambio de presión transpulmonar (Fig. 3-5).
En suma, los alvéolos de la base están menos distendidos al comienzo de la inspiración, pero aumentan marcadamente de volumen a medida que avanza esta fase; en cambio, los alvéolos del vértice, inicialmente más distendidos, tienen poco margen de expansión y, por lo tanto, ventilan menos. Existen algunos mecanismos que limitan las desviaciones excesivas de la relación entre ventilación y perfusión. En las áreas ventiladas, pero mal perfundidas, se produce una broncoconstricción debido a la caída de PACO2 o hipocapnia alveolar. El consiguiente aumento de la resistencia al flujo aéreo dirige el aire inspirado hacia zonas mejor perfundidas. Por otra parte, la disminución de PaO2 en áreas mal ventiladas provoca vasoconstricción local y : el aumento de resistencia vascular resultante redistribuye la sangre hacia las zonas bien ventiladas. / Evaluación de las
relaciones
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla
3-3 VALORES NORMALES DE DE PaO2 Y PA-aO2 PARA SANTIAGO, CHILE (PRESIÓN BAROMÉTRICA MEDIA DE 715 MM Hg |
||
|---|---|---|
| Edad | PA - aO2* | PaO2 ** |
| 10
|
2
|
88
|
| 15
|
4
|
86
|
| 20
|
5
|
85
|
| 25
|
7
|
83
|
| 30
|
8
|
82
|
| 35
|
10
|
80
|
| 40
|
11
|
79
|
| 45
|
13
|
77
|
| 50
|
14
|
76
|
| 55
|
15
|
74
|
| 60
|
17
|
73
|
| 65
|
19
|
71
|
| 70
|
20
|
70
|
| 75
|
22
|
68
|
| 80
|
23
|
67
|
| 85
|
25
|
65
|
| 90
|
26
|
64
|
* Desviación estándar : 5 mmHg . Diferencias iguales o inferiores a
este valor no son necesariamente patológicas
** Fórmulas aproximadas para Santiago: PaO2 = 91 - 1/3 de edad
La PaCO2.es un buen indicador de la función ventilatoria global de la bomba respiratoria y la PA - aO2 es es un buen índice de como funciona la relación ventilación/perfusión en el intercambiador de gases
 |