|
|
|
| |
Aunque la ventilación alveolar global esté
dentro de límites normales, pueden existir importantes
trastornos de la hematosis por desajustes locales de la relación
entre ventilación y perfusión alveolar. Como
se vio en el capítulo correspondiente de fisiología,
la relación global entre la ventilación global
y la perfusión total ( )
representa el promedio de las múltiples situaciones
que existen en diferentes territorios alveolares y puede oscilar
entre 0,1 y 10, aunque generalmente se centra en un cuociente
de 0,8 con un rango entre 0,3 y 2,1. El equilibrio entre situaciones
contrapuestas y el juego de mecanismos compensatorios es tal
que, normalmente, se mantiene una relación global bastante
estable. )
representa el promedio de las múltiples situaciones
que existen en diferentes territorios alveolares y puede oscilar
entre 0,1 y 10, aunque generalmente se centra en un cuociente
de 0,8 con un rango entre 0,3 y 2,1. El equilibrio entre situaciones
contrapuestas y el juego de mecanismos compensatorios es tal
que, normalmente, se mantiene una relación global bastante
estable.
Cuando, en condiciones patológicas, los desequilibrios
locales alcanzan una magnitud y/o extensión suficientes,
se produce una ruptura de la proporcionalidad entre ventilación
y perfusión, con trastornos de los gases en sangre
arterial. Estas alteraciones pueden tener lugar en los siguientes
sentidos:
1.- Predominio de ventilación
sobre perfusión (  /Q
> 1,0), lo que significa aumento del espacio muerto fisiológico
2.-Predominio de perfusión sobre ventilación
(  /Q bajo 0,8
).lo que significa paso de sangre que no ha perdido su carácter
venosos.al lado arterial
AUMENTO DEL ESPACIO MUERTO : /Q
ALTA /Q
ALTA
Cuando disminuye o se suprime la perfusión de un
territorio alveolar ventilado, la situación es equivalente
a la de las vías aéreas, donde hay ventilación
sin hematosis , constituyendose un espacio muerto fisiológico.
Si el aumento del espacio muerto es leve o moderado, la
ventilación malgastada puede compensarse aumentando
la ventilación/ minuto, de manera que la cantidad
de aire que llega a los alvéolos bien perfundidos
continúa siendo la normal. Con ello los gases arteriales
se mantienen normales, aunque con un mayor gasto energético
en ventilación.
CAUSAS
El aumento del espacio muerto fisiológico puede
generarse por 2 caminos diferentes:
1.-Disminución funcional o anatómica
del lecho capilar: embolias pulmonares, fibrosis del intersticio
pulmonar, destrucción de tabiques en enfisema, vasoconstricción
pulmonar, etc.
2.-Aumento de tamaño de los espacios aéreos,
lo que significa la existencia de masas de aire que tienen
contacto con capilares sólo en su periferia. Se observa
en enfisema, bulas, quistes aéreos, etc.
CONSECUENCIAS FUNCIONALES Y CLINICAS
Por las razones ya expuestas, el trastorno leve o moderado
carece, en general, de traducción en los gases en
sangre arterial y no altera volúmenes pulmonares
ni flujos aéreos. Su única expresión
puede ser la hiperpnea, que puede producir disnea (sensación
subjetiva de dificultad respiratoria) en pacientes con capacidad
ventilatoria limitada.
Si por su magnitud el espacio muerto capta gran parte de
la ventilación se produce hipoxemia y retención
de CO2 por hipoventilación
de las zonas que mantienen el intercambio gaseoso.
La medición del espacio muerto es indirecta y relativamente
compleja, por lo que su uso sólo se justifica en
investigación y en casos clínicos calificados.
1.-Aumentos regionales de la resistencia de
la vía aérea
2.-Aumentos regionales de la perfusión
capilar que no son acompañados de un ajuste suficiente
de la ventilación
3.-Disminución local o general de distensibilidad
con aumento de resistencia friccional de los
tejidos.
4.-Limitaciónes regionales de la movilidad torácica
CONSECUENCIAS FUNCIONALES
Para abordar este importante aspecto es útil analizar
algunas situaciones que se esquematizan a continuación.
Al examinar estos esquemas no se debe pretender memorizar
los detalles sino que comprender los mecanismos de las alteraciones
y sus compensaciones .
Es importante tener presente que al mezclarse sangre capilar
de distintos territorios alveolares con diferentes presiones
y contenidos de O2,
lo que se promedia no son las presiones del gas sino los
contenidos y que del contenido resultante se infiere de
la presión de O2
de la mezcla Esto se debe a que el contenido o número
de moléculas de O2
de la mezcla es la suma aritmética directa
de las moléculas aportadas por los diferentes territorios
alveolo-capilares y , por la forma de la curva de la hemoglobina,
un mismo contenido se asocia a diferentes presiones
según el punto de la curva en que, por la presión
de su contenido, está cada territorio alveolar contribuyente
a la mezcla.
La figura 10-1 es un esquema de un pulmón formado
por dos unidades alvéolo-capilares, A y B, una de
las cuales tiene una obstrucción de la vía
aérea con disminución de la ventilación
local.
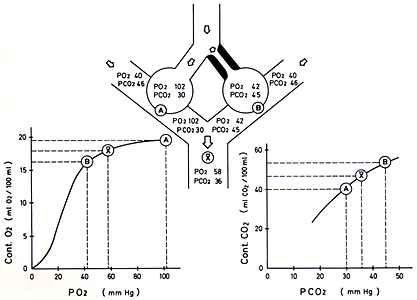
Figura 10-2. Disminución
de la relación  /Q:
efecto de la hiperventilación compensatoria. En
la figura se observan dos unidades alvéolo-capilares
que tienen igual perfusión. La unidad B presenta
obstrucción bronquial con disminución de
la PAO2
y aumento de la PACO2.
La unidad A está hiperventilando compensatoriamente
y, por consiguiente, tiene una relación  /Q
alta con elevación de la PAO2
y caída de la
PACO2.
Los gráficos situados en la parte inferior de la
figura muestran las curvas presion-contenido del O2
y CO2
de la sangre proveniente
de las zonas A y B y el de la sangre mezclada (x). Se
puede observar que la hiperventilación de A es
capaz de corregir la P CO2
de la sangre mezclada y que, en cambio, no compensa
totalmente la PaO2,
pues la sangre mezclada presenta hipoxemia. Esta diferencia
de comportamiento se debe a que la forma de las curvas
de disociación de la hemoglobina y la del CO2
son distintas. En la parte horizontal de la curva
de la hemoglobina un aumento compensatorio de la PAO2
no incrementa significativamente el contenido de O2
. En cambio, la disminución de la PACO2
disminuye casi linealmente el contenido sanguíneo
de CO2, por lo que
la PCO2 de la sangre
mixta disminuye a valores normales.
El flujo sanguíneo para ambas unidades es igual,
de manera que la unidad B con ventilación limitada
tiene su relación  /Q
disminuida. La sangre venosa que ingresa a ambas unidades
es la misma con una PO2
de 40 y una PCO2 de
46mmHg. Como mecanismo compensatorio, la unidad A hiperventila,
con caída de la PACO2
a 30 mmHg y alza de la PaCO2
a 102 mmHg. La unidad B, con su ventilación limitada
por obstrucción bronquial , tiene una PAO2
de 42 y una PaCO2
de 45 mmHg. En las unidades A y B la
PaO2 y PaCO2
de la sangre capilar se han equilibrado completamente con
las presiones de los respectivos gases alveolares debido
a que no existe ninguna barrera o trastorno de difusión
entre ambos compartimentos. /Q
disminuida. La sangre venosa que ingresa a ambas unidades
es la misma con una PO2
de 40 y una PCO2 de
46mmHg. Como mecanismo compensatorio, la unidad A hiperventila,
con caída de la PACO2
a 30 mmHg y alza de la PaCO2
a 102 mmHg. La unidad B, con su ventilación limitada
por obstrucción bronquial , tiene una PAO2
de 42 y una PaCO2
de 45 mmHg. En las unidades A y B la
PaO2 y PaCO2
de la sangre capilar se han equilibrado completamente con
las presiones de los respectivos gases alveolares debido
a que no existe ninguna barrera o trastorno de difusión
entre ambos compartimentos.
La PaO2
de la mezcla de sangres provenientes de las dos unidades
estará determinada por su contenido final de O2.
Para ello es necesario conocer los contenidos de O2
de la sangre de cada zona, deducidos de la curva de disociación
de la Hb incluida en la misma figura. El contenido de la
sangre proveniente de A es 19,8 ml/dl y el de B es de 16,3
ml/dl. Dado que ambas unidades tienen igual perfusión,
el contenido de O2
de la sangre mezclada es 18,5, promedio de las cifras antes
anotadas. Conviene destacar que la PaO2
de la mezcla con este contenido es, de acuerdo a
la curva de disociación de la Hb, de 58 mmHg, cifra
diferente al promedio aritmético de la presión
de oxígeno de A y B. La razón de esta diferencia
está en la forma no lineal de la relación
entre el contenido y la presión de
O2
Debido a que la curva de disociación del
es una recta, el comportamiento
de este gas difiere marcadamente de lo anterior. Siguiendo
el mismo raciocinio utilizado para el O2
se podría calcular que el contenido de CO2
de la sangre mixta es
el promedio de los contenidos de la sangre proveniente de
las zonas A y B, pero no es necesario porque, a diferencia
de lo que ocurre con el oxígeno PO2,
la PCO2
de la sangre mixta corresponde aproximadamente al
promedio aritmético de la PCO2
de la sangre proveniente de ambas zonas, debido
a que la relación contenido/presión para el
CO2 es lineal.
Evidentemente, las cifras del ejemplo de la Figura 10-1
cambiarían si la perfusión sanguínea
de las zonas pulmonares en cuestión fuera diferente.
Por otra parte, si la obstrucción fuera completa
o el alvéolo estuviese colapsado u ocupado por edema,
la PaO2
y PaCO2
de la sangre proveniente de la zona alterada serían
iguales a la venosa.
Al mezclarse la sangre de las unidades con  /Q
bajo con la de las unidades que reciben mayor ventilación,
se produce una corrección que tiene un efecto limitado
sobre la baja PaO2
o hipoxemia pero muy marcado sobre el aumento de
PaCO2 o
hipercarbia presentes en la sangre de la zona alterada.
En el caso del oxígeno esto se debe a que, con una
PO2 sobre 90 mmHg la
hemoglobina se encuentra casi completamente saturada. Por
ello, el incremento de PO2
de la zona hiperventilada prácticamente no aumenta
el contenido de O2
lo suficiente como para que corrija la disminución
del contenido de O2
de la mezcla. En cambio la disminución de la presión
de CO2
se acompaña de una disminución proporcional
del contenido de CO2,
cuyo efecto corrector en la mezcla de sangre arterial será,
en consecuencia, importante. /Q
bajo con la de las unidades que reciben mayor ventilación,
se produce una corrección que tiene un efecto limitado
sobre la baja PaO2
o hipoxemia pero muy marcado sobre el aumento de
PaCO2 o
hipercarbia presentes en la sangre de la zona alterada.
En el caso del oxígeno esto se debe a que, con una
PO2 sobre 90 mmHg la
hemoglobina se encuentra casi completamente saturada. Por
ello, el incremento de PO2
de la zona hiperventilada prácticamente no aumenta
el contenido de O2
lo suficiente como para que corrija la disminución
del contenido de O2
de la mezcla. En cambio la disminución de la presión
de CO2
se acompaña de una disminución proporcional
del contenido de CO2,
cuyo efecto corrector en la mezcla de sangre arterial será,
en consecuencia, importante.
La diferencia alvéolo-arterial de oxígeno
aumenta, ya que, al mismo tiempo que cae la PaO2
por efecto de la admisión venosa, la hiperventilación
de los territorios más normales aumenta la PAO2
promedio. Este hecho es muy importante en clínica,
ya que si sólo consideramos la PaO2,
una disminución de  /Q
bien compensada pasa inadvertida. En cambio, la diferencia
alvéolo-arterial aumentada es el índice más
sensible de /Q
bien compensada pasa inadvertida. En cambio, la diferencia
alvéolo-arterial aumentada es el índice más
sensible de  /Q
disminuido. /Q
disminuido.
Por esta característica este examen sería
el mas indicado para monitorizar el tratamiento de un paciente
con disminución de  /Q, pero la administración de oxigeno que necesitan
muchos de estos pacientes distorsiona la medición
de este indicador. Esto se debe a que la diferencia de presión
entre alveolo y arteria es básicamente generada por
la disminución del contenido arterial de O2
secundaria a la admisión venosa. Cuando se está
recibiendo oxigeno el proceso de captación de este
gas por la Hb se desarrolla en la parte horizontal de
la curva de disociación, donde un pequeño
cambio de contenido se traduce por un gran cambio de presión,
lo que magnifica artificialmente la diferencia alveolo-arterial
aunque el trastorno
/Q, pero la administración de oxigeno que necesitan
muchos de estos pacientes distorsiona la medición
de este indicador. Esto se debe a que la diferencia de presión
entre alveolo y arteria es básicamente generada por
la disminución del contenido arterial de O2
secundaria a la admisión venosa. Cuando se está
recibiendo oxigeno el proceso de captación de este
gas por la Hb se desarrolla en la parte horizontal de
la curva de disociación, donde un pequeño
cambio de contenido se traduce por un gran cambio de presión,
lo que magnifica artificialmente la diferencia alveolo-arterial
aunque el trastorno  /Q
no haya variado.Para superar este inconveniente se
ensayado otros índices y entre estos el que resulta
útil por su simplicidad es la relación
entre presión arterial de O2 y la
fracción inspirada de O2 (PaFi). Con
una PaO2
normal de 90 y respirando aire la relación será
de 90 / 0,21 = 428. . Si hay una alteración pulmonar
con /Q
no haya variado.Para superar este inconveniente se
ensayado otros índices y entre estos el que resulta
útil por su simplicidad es la relación
entre presión arterial de O2 y la
fracción inspirada de O2 (PaFi). Con
una PaO2
normal de 90 y respirando aire la relación será
de 90 / 0,21 = 428. . Si hay una alteración pulmonar
con  /Q
bajo que, supongamos, baja la PaO2
a 45, la relación caerá a 214. Al administrar
oxigeno subirán tanto la fracción inspirada
como la PaO2 y la relación
cambiará nada o poco.En cambio si el daño
pulmonar empeora caerá la PaO2 ,
y como la fracción inspirada
de oxigeno se mantiene igual , la relación se reducirá
aun más. En suma , los cambios de fracción
inspirada de oxigeno no cambian la PaFi y mientras que las
variaciones de /Q
bajo que, supongamos, baja la PaO2
a 45, la relación caerá a 214. Al administrar
oxigeno subirán tanto la fracción inspirada
como la PaO2 y la relación
cambiará nada o poco.En cambio si el daño
pulmonar empeora caerá la PaO2 ,
y como la fracción inspirada
de oxigeno se mantiene igual , la relación se reducirá
aun más. En suma , los cambios de fracción
inspirada de oxigeno no cambian la PaFi y mientras que las
variaciones de  /Q
modifican la relación marcadamente. Aunque este indicador
no es el más sensible para detectar alteraciones /Q
modifican la relación marcadamente. Aunque este indicador
no es el más sensible para detectar alteraciones
 /Q ,
si está cercano o bajo 200 indica un trastorno grave. /Q ,
si está cercano o bajo 200 indica un trastorno grave.
Los trastornos con disminución de  /Q
son la causa más frecuente de hipoxemia
con efectos muy variados por la multiplicidad de
combinaciones , variabilidad de las alteraciones
y persistencia de áreas capaces de hiperventilar.
Si las áreas alteradas son muy extensas y
quedan pocas áreas capaces de ventilar, la
situación equivale a una hipoventilación
alveolar y se agrega hipercarbia. /Q
son la causa más frecuente de hipoxemia
con efectos muy variados por la multiplicidad de
combinaciones , variabilidad de las alteraciones
y persistencia de áreas capaces de hiperventilar.
Si las áreas alteradas son muy extensas y
quedan pocas áreas capaces de ventilar, la
situación equivale a una hipoventilación
alveolar y se agrega hipercarbia.
|
CORTOCIRCUITO :  /Q =
0 /Q =
0
La perfusión de áreas no
ventiladas significa que a la sangre arterializada en el
resto del pulmón se agrega sangre que conserva totalmente
su carácter venoso, lo que se constituye un cortocircuito
( shunt en ingles), forma extrema de admisión venosa
La sangre que escapa totalmente a la hematosis puede
pasar por diferentes vías:
-Comunicaciones anatómicas normales
entre el lado derecho y el izquierdo de la circulación,
como las venas bronquiales y venas de Tebesio, que drenan
sangre venosa a las venas pulmonares y al corazón
izquierdo respectivamente sin pasar por la red capilar
pulmonar.
-Conexiones patológicas, como se
observa en las fístulas arteriovenosas pulmonares
y en las comunicaciones intracardíacas, constituyendo
todos ellos cortocircuitos extrapulmonares.
-Capilares de territorios alveolares totalmente
excluidos de ventilación (  /Q
=0), que constituyen el cortocircuito intrapulmonar propiamente
tal.
CAUSAS DE CORTOCIRCUITO INTRAPULMONAR
El cortocircuito intrapulmonar puede producirse básicamente
en dos circunstancias:
-Ocupación o relleno alveolar por líquido,
como ocurre en el edema pulmonar, ya sea cardiogénico
o por permeabilidad aumentada, o en las neumonías.
por secreciones y material inflamatorio
-Colapso alveolar en atelectasias.
CONSECUENCIAS FUNCIONALES
La Figura 10-3 esquematiza, a la izquierda,
un pulmón formado por dos unidades alvéolo-capilares,
A y B, en que la unidad B tiene una ocupación completa
del espacio alveolar por edema, de manera que su ventilación
es nula y su relación  /Q
es igual a cero, o sea, un cortocircuito intrapulmonar. /Q
es igual a cero, o sea, un cortocircuito intrapulmonar.
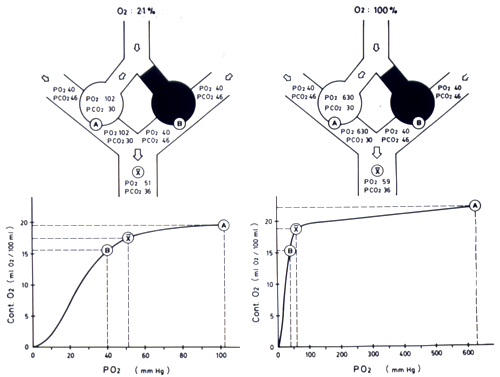
Figura 10-3 Efecto del
O2 100% sobre la
PO2 en un cortocircuito. La figura es
similar a la 10-1 pero el trastorno en este caso es un
cortocircuito por ocupación del espacio alveolar
de la unidad B. Respirando aire, la PO2
de la sangre arterial mezclada es , obviamente, menor
que en el ejemplo con disminución de la relación
 /Q. En
los casos con cortocircuito la administración de
O2 100% modifica
escasamente la PO2de
la sangre mezclada. Esto se debe a que la sangre proveniente
de la unidad B no se ha puesto en contacto con el O 2
administrado y por lo tanto no ha modificado su bajo contenido
de O 2. Por otra parte,
el pequeño aumento de contenido de O2
producido por el O 2
100% en la unidad A no es suficiente como para compensar
el bajo contenido de O 2
de la unidad B.
Asumiremos, al igual que en el ejemplo
anterior y en beneficio de la simplicidad, que el flujo
sanguíneo para ambas unidades es similar. La
PO2 y PCO2
de la sangre venosa que ingresa a ambas unidades
son 40 y 46 mmHg, respectivamente. Como mecanismo compensatorio,
la unidad A hiperventila con caída de la PACO2
a 30 mmHg y alza de la PAO2
a 102 mmHg. La sangre venosa que pasa por la unidad
B, que no participa en la hematosis, permanece inalterada.
En la unidad A, la PaO2
y PaCO2
de la sangre capilar se equilibran completamente con
las presiones de los respectivos gases alveolares.
La PaO2
de la mezcla de sangres provenientes de las
dos unidades estará determinada por el contenido
final de O2 de
la mezcla, a partir de los contenidos de O2
de la sangre de cada zona, deducidos de la curva de
disociación de la Hb incluida en la misma figura.
El contenido de la sangre proveniente de A es 19,8 ml/dl
y el de B es de 15,2 ml/dl. Dado que ambas unidades
tienen igual perfusión, el contenido de O2
de la sangre mezclada es 17,5, promedio de las cifras
antes anotadas. La PaO2
de la mezcla con este contenido será,
de acuerdo a la curva de disociación de la Hb,
de 51 mmHg.
ADMINISTRACION DE O2
EN TRASTORNOS  /Q /Q
a) En presencia de relaciones  /Q
bajas /Q
bajas
En la Figura 10-4 se muestran los efectos
de administración de O2
en alta concentración sobre los gases arteriales
en un pulmón similar al de la Figura 10-1.
Figura 10-4. Efecto
del O2
100% sobre la PO2
en un caso con disminución de la relación
 /Q
. Cada figura muestra dos unidades alvéolo-capilares,
una de ellas con obstrucción de su vía
aérea y disminución de su relación
 /Q.
En la parte inferior se muestra una curva de disociación
de la hemoglobina con los valores de PO2
y contenido de O2
de la sangre que abandona las unidades A y B y de
la mezcla de ambas (x). La figura de la izquierda
representa la situación respirando aire y la
de la derecha aquélla respirando 100% de O2.
Al igual que en la Figura 9-2, existe hipoxemia respirando
aire. La administración de 100% de O2
aumenta más la PAO2
de la unidad A que de la unidad B, pero las diferencias
de contenido de O2
son mínimas. En estas condiciones la PO2
de la sangre mezclada (x) es muy superior a la observada
respirando aire.
Al dar O2 100%,
la PaO2
de la unidad A sube a 630 mmHg. Debido a su baja ventilación,
la PaO2
de la zona B sólo sube a 260 mmHg. En las curvas
de disociación de la hemoglobina correspondientes
se ha calculado la PaO2
resultante de promediar los contenidos de O2.
Se puede observar que la PO2
de la sangre mezclada sube a 445 cuando se respira O2
100%.
b) En presencia de cortocircuito
En la Figura 10-3 , a la derecha, se ilustra el efecto
de la administración de O2 100% en un modelo
de cortocircuito. La PO2
de la sangre mezclada respirando aire es en este caso
menor que en el ejemplo anterior, pues la sangre de
la unidad B no se modificó en su pasada por el
alvéolo y mantiene una PO2
y una PCO2 correspondientes
a sangre venosa. Se puede apreciar que, al respirar
O2 100%, la composición
de la sangre que sale de la unidad B no se ha modificado,
ya que no ha estado en contacto con el oxígeno
administrado, y que la de la unidad A ha mejorado muy
poco su contenido de O2,
ya que desde antes estaba casi saturada. Por estas razones,
la PO2 de la sangre
mezclada sólo se ha elevado sólo de 51
a 59 mmHg.
La administración de
O2 100% permite diferenciar si el mecanismo causante
de una hipoxemia es una disminución de
la relación VQ o un cortocircuito absoluto
(  /Q
= 0). |
Es importante resaltar que el
uso de O2 100%
magnifica el efecto que tiene la sangre del cortocircuito
sobre la mezcla resultante. En la figura
10-3 vemos que, respirando, aire la PaO2
de la zona normal es de 102 mmHg y cae a
51 por la admisión venosa admisión
venosa de esquema. Respirando oxigeno 100% , la
misma admisión venosa hace caer la PaO2
de la zona normal de 630 a 59 en la mezcla. Esto
se debe a que, a presiones altas, la relación
contenido/presión corresponde a la porción
horizontal de la curva de disociación de la Hb,
por lo que la caída de contenido producida
por el cortocircuito, aunque sea modesta, se traduce
en una gran caída de la PaO2
que resulta fácil evidenciar . Esta particularidad
se aprovecha en casos clínicos en tratamiento
intensivo para detectar y cuantificar aproximadamente
la magnitud de los cortocircuitos, usando una muestra
de sangre venosa mixta de la arteria pulmonar a través
de un catéter que se introduce por una vena periférica
hasta el corazón derecho.
La diferenciación entre cortocircuito y desequilibrio
de las relaciones  /Q
tiene importancia diagnóstica y terapéutica,
ya que si existe efecto cortocircuito, los esfuerzos
deben dirigirse a expandir o ventilar los alvéolos
ocupados o colapsados, sin lo cual la oxigenoterapia
será de efecto limitado. |
EFECTOS DEL EJERCICIO SOBRE LA PaO2
El efecto del ejercicio sobre los gases arteriales en
pacientes con trastornos de la relación  /Q
es complejo y no siempre previsible. En algunos enfermos
con disminución de la relación /Q
es complejo y no siempre previsible. En algunos enfermos
con disminución de la relación  /Q
causada por espasmo del músculo liso bronquial
(asma), es posible observar broncodilatación durante
el ejercicio, con mejoría de la /Q
causada por espasmo del músculo liso bronquial
(asma), es posible observar broncodilatación durante
el ejercicio, con mejoría de la  A
regional y, por consiguiente, de la relación A
regional y, por consiguiente, de la relación  /Q,
mientras que en otros asmáticos que presentan espasmo
bronquial precisamente a consecuencia del ejercicio, este
agrava el V/Q y la hipoxemia. Aunque el grado de obstrucción
bronquial no varíe con el ejercicio, la ventilación
regional puede disminuir debido a que las zonas obstruidas
no tienen tiempo de vaciarse durante la espiración
acortada por la mayor frecuencia respiratoria. Otras veces
el ejercicio aumenta más el volumen corriente que
la frecuencia, mejorando la ventilación de zonas
hipoventiladas. /Q,
mientras que en otros asmáticos que presentan espasmo
bronquial precisamente a consecuencia del ejercicio, este
agrava el V/Q y la hipoxemia. Aunque el grado de obstrucción
bronquial no varíe con el ejercicio, la ventilación
regional puede disminuir debido a que las zonas obstruidas
no tienen tiempo de vaciarse durante la espiración
acortada por la mayor frecuencia respiratoria. Otras veces
el ejercicio aumenta más el volumen corriente que
la frecuencia, mejorando la ventilación de zonas
hipoventiladas.
En trastornos  /Q
con efecto cortocircuito, es frecuente que, durante el
ejercicio, el flujo sanguíneo por el cortocircuito
aumente. Además, la PaO2
puede caer porque la mayor extracción periférica
de O2 determina una
caída del contenido de O2
de la sangre venosa, lo que aumenta el efecto de la admisión
venosa sobre la PaO2. /Q
con efecto cortocircuito, es frecuente que, durante el
ejercicio, el flujo sanguíneo por el cortocircuito
aumente. Además, la PaO2
puede caer porque la mayor extracción periférica
de O2 determina una
caída del contenido de O2
de la sangre venosa, lo que aumenta el efecto de la admisión
venosa sobre la PaO2.
De lo expuesto se deduce que los cambios en los gases
arteriales con el ejercicio no son indicadores seguros
de determinado mecanismo fisiopatológico de hipoxemia.
No obstante, el examen es útil, en conjunto con
el resto del estudio funcional, para investigar la eficacia
del pulmón bajo condiciones de mayor exigencia
y poner de manifiesto o exagerar alteraciones ocultas
en el reposo.
TRASTORNOS DE DIFUSION
Teóricamente, es posible suponer que una unidad
alveolar que recibe una ventilación adecuada y
una perfusión proporcional no presente una hematosis
normal porque la membrana alvéolo-capilar está
engrosada y bloquea el paso de los gases, especialmente
el oxígeno. Este tipo de anomalía se ha
denominado trastorno de difusión. En la realidad,
sin embargo, la situación no se produce en forma
pura, ya que el engrosamiento de la membrana es parte
de una patología intersticial que altera la ventilación
alveolar regional por rigidez del parénquima y
comprime o destruye capilares. Por estas razones el trastorno
de difusión por bloqueo alvéolo-capilar
es más bien una abstracción conceptual de
un fenómeno inseparable de los trastornos  /Q
que se observan en enfermedades del intersticio. /Q
que se observan en enfermedades del intersticio.
Como vimos en el capítulo correspondiente de fisiología,
los métodos clínicos utilizados en la medición
de la difusión de gases son inespecíficos,
pues no sólo se alteran con los trastornos de la
difusión propiamente tal, sino también por
alteraciones de la relación  /Q
y por disminución del área de membrana. /Q
y por disminución del área de membrana.
CONSECUENCIAS FUNCIONALES
El engrosamiento de la membrana alvéolo-capilar
por si mismo no es capaz de alterar el intercambio de
gases en reposo, pero si puede provocar hipoxemia en ejercicio.
Esto se explica porque la aceleración de la circulación
del ejercicio acorta el tiempo de tránsito de la
sangre por la zona de intercambio gaseoso y el paso del
O2 a través
de la membrana engrosada es más lento que lo normal
(Figura 3-2). Con la administración de O2
al 40%, la hipoxemia se corrige, ya que no hay obstáculo
para que el gas llegue a los alvéolos e incremente
marcadamente la diferencia de presión entre aire
y sangre venosa, superándose así el obstáculo
de difusión.
El CO2
muy raramente se altera por este mecanismo, por
ser 20 veces más difusible que el O2.
y. aunque pueden producirse limitaciones para su eliminación
en territorios muy dañados, la eficiencia de la
hiperventilación compensatoria para este gas es
tal que, usualmente, la PaCO2
es normal.
La medición de la difusión
se hace a través de la capacidad de difusión
para O2 o para CO,
definida como la cantidad de gas en ml que es transferida
en un minuto por cada mmHg de diferencia de presión
media de este gas entre el alvéolo y el capilar.
Los métodos para medirla son complejos y sujetos
a reparos, ya que dependen fuertemente de la relación
 /Q y no
todas las técnicas miden lo mismo. Por esta razón,
cuando se emplea en clínica no se pretende estar
midiendo sólo la difusión, sino una combinación
de ésta con factores /Q y no
todas las técnicas miden lo mismo. Por esta razón,
cuando se emplea en clínica no se pretende estar
midiendo sólo la difusión, sino una combinación
de ésta con factores  /Q
y de área de membrana. /Q
y de área de membrana.
Para las necesidades clínicas,
en general, no es necesario identificar y evaluar en todo
su detalle cada uno de los mecanismos que hemos analizado,
ya que su estudio fisiopatológico es demasiado
complejo, especialmente en los frecuentes casos mixtos,
y los datos clínicos y radiológicos pueden
aportar elementos suficientes para tomar decisiones.
|
Clínicamente se considera que el diagnóstico
de trastorno de difusión está suficientemente
fundamentado si se constata una hipoxemia que se
exagera con el ejercicio y se corrige con oxígeno
al 40%, en el contexto de una enfermedad que afecta
el intersticio pulmonar |
|
|
|
![]() /Q
es complejo y no siempre previsible. En algunos enfermos
con disminución de la relación
/Q
es complejo y no siempre previsible. En algunos enfermos
con disminución de la relación ![]() /Q
causada por espasmo del músculo liso bronquial
(asma), es posible observar broncodilatación durante
el ejercicio, con mejoría de la
/Q
causada por espasmo del músculo liso bronquial
(asma), es posible observar broncodilatación durante
el ejercicio, con mejoría de la ![]() A
regional y, por consiguiente, de la relación
A
regional y, por consiguiente, de la relación ![]() /Q,
mientras que en otros asmáticos que presentan espasmo
bronquial precisamente a consecuencia del ejercicio, este
agrava el V/Q y la hipoxemia. Aunque el grado de obstrucción
bronquial no varíe con el ejercicio, la ventilación
regional puede disminuir debido a que las zonas obstruidas
no tienen tiempo de vaciarse durante la espiración
acortada por la mayor frecuencia respiratoria. Otras veces
el ejercicio aumenta más el volumen corriente que
la frecuencia, mejorando la ventilación de zonas
hipoventiladas.
/Q,
mientras que en otros asmáticos que presentan espasmo
bronquial precisamente a consecuencia del ejercicio, este
agrava el V/Q y la hipoxemia. Aunque el grado de obstrucción
bronquial no varíe con el ejercicio, la ventilación
regional puede disminuir debido a que las zonas obstruidas
no tienen tiempo de vaciarse durante la espiración
acortada por la mayor frecuencia respiratoria. Otras veces
el ejercicio aumenta más el volumen corriente que
la frecuencia, mejorando la ventilación de zonas
hipoventiladas. ![]() /Q
con efecto cortocircuito, es frecuente que, durante el
ejercicio, el flujo sanguíneo por el cortocircuito
aumente. Además, la PaO2
puede caer porque la mayor extracción periférica
de O2 determina una
caída del contenido de O2
de la sangre venosa, lo que aumenta el efecto de la admisión
venosa sobre la PaO2.
/Q
con efecto cortocircuito, es frecuente que, durante el
ejercicio, el flujo sanguíneo por el cortocircuito
aumente. Además, la PaO2
puede caer porque la mayor extracción periférica
de O2 determina una
caída del contenido de O2
de la sangre venosa, lo que aumenta el efecto de la admisión
venosa sobre la PaO2.
![]() /Q
que se observan en enfermedades del intersticio.
/Q
que se observan en enfermedades del intersticio. ![]() /Q
y por disminución del área de membrana.
/Q
y por disminución del área de membrana.
![]() /Q y no
todas las técnicas miden lo mismo. Por esta razón,
cuando se emplea en clínica no se pretende estar
midiendo sólo la difusión, sino una combinación
de ésta con factores
/Q y no
todas las técnicas miden lo mismo. Por esta razón,
cuando se emplea en clínica no se pretende estar
midiendo sólo la difusión, sino una combinación
de ésta con factores ![]() /Q
y de área de membrana.
/Q
y de área de membrana. 