|
|
|
| |
Como ya se ha enfatizado, la identificación
de los agentes causales de las neumonías es difícil
debido a las limitaciones de sensibilidad y especificidad de los
distintos procedimientos diagnósticos. Por ello el manejo
diagnóstico y terapéutico de las neumonías
se realiza, satisfactoriamente en la mayoría de los casos
con tratamientos antibióticos empíricos, adecuados
a la categoría de la neumonía. Sin embargo, como
existen casos en que se conoce o se puede presumir un agente especifico
porque existe un contexto epidemiológico, hay claros factores
de riesgo, indicadores clínicos sugerentes de un germen
determinado o un resultado de exámenes que lo demuestra,
es conveniente conocer algunas características asociadas
a etiologías especificas que permiten optimizar el tratamiento
y precisar el pronóstico. Esto es muy significativo en
algunas neumonías que tienen tratamientos con drogas
muy específicas, como ser las por virus influenza o por
Pneumocystis Jiroveci
Aunque o es necesario memorizar los detalles
expuestos en este capítulo, es necesario saber que existen
para saber donde buscarlos buscarlos cuando sea necesario.
NEUMONIA NEUMOCOCICA
ETIOLOGÍA
El Streptococcus pneumoniae es una
bacteria que coloniza la faringe de un 15 a 50% de los individuos
normales. La adherencia del neumococo a la mucosa bronquial
y su colonización aumentan con el tabaquismo y con las
infecciones virales, lo que explica que la incidencia de neumonía
neumocócica sea mayor en fumadores y en la época
invernal. De acuerdo a la estructura de su cápsula polisacárida,
se han identificado 84 serotipos de neumococos, que difieren
en su virulencia. Esto permite comprender, en parte, la variabilidad
que presenta el cuadro clínico y la gravedad, ya que
hay serotipos que producen siempre una enfermedad grave mientras
que otros son menos patógenos. Actualmente no es útil
la identificación del serotipo de neumococo, pero en
la era preantibiótica ella era indispensable para los
tratamientos con sueros que eran específicos para cada
tipo. La inmunidad específica para cada tipo es de duración
limitada, lo que explica que se pueda observar múltiples
episodios de neumonía neumocócica en un mismo
paciente. Lo anterior, además, explica que la vacunación
antineumocócica deba incluir la mayor parte de los serotipos
frecuentes en la población y que necesite repetirse cada
3-5 años en los individuos más susceptibles.
La virulencia del neumococo radica en su capacidad
de multiplicarse en el espacio extracelular, lo que logra gracias
a su cápsula polisacárida que le permite resistir
la fagocitosis. Este hecho ha sido demostrado en animales de
experimentación, en los que sólo se necesitan
entre 1 y 10 microorganismos capsulados para producir una enfermedad
mortal, mientras que la dosis letal de neumococos sin cápsula
es un millón de veces mayor. La presencia de cápsula
está relacionada también con la curación
de la neumonía neumocócica. Al
comenzar la producción de anticuerpos anticapsulares,
entre 5 y 10 días de iniciada la enfermedad, se produce
una caída dramática de la intensidad de los síntomas,
debido a que estos anticuerpos actúan como opsoninas
que activan el complemento y permiten la fagocitosis de los
neumococos. Estas observaciones permiten comprender por qué
los pacientes con enfermedades que alteran estos mecanismos
de defensa sean muy susceptibles al neumococo y otros gérmenes
capsulados. Entre éstas cabe destacar todas las condiciones
que producen granulocitopenia o déficit de producción
de anticuerpos, como mieloma múltiple, leucemia linfática
crónica, tratamiento crónico con esteroides, etcétera.
La ausencia de exotoxinas destructoras permite
explica por que la neumonía neumocócica rara vez
evoluciona hacia la excavación o a una neumonía
necrotizante, y que la curación sea completa y sin secuelas
en la mayoría de los casos.
PATOGENIA
El neumococo llega a la vía aérea
periférica y el territorio alveolar por aspiración
de secreciones bucofaríngeas y, en condiciones adecuadas,
comienza a multiplicarse e induce edema local que facilita su
diseminación a los alvéolos vecinos. La presencia
de edema pulmonar preexistente, como ocurre en la insuficiencia
cardíaca congestiva, facilita su diseminación.
En un 20-30% de los casos se produce bacteremia,
que es un índice de mal pronóstico, pues aumenta
la letalidad entre 2 y 3 veces. Con frecuencia se extiende a
la pleura y en algunos pacientes se observan focos metastásicos
en meninges, articulaciones, endocardio y pericardio. La gravedad
de la enfermedad bacterémica es mucho mayor en los pacientes
esplenectomizados, ya que este órgano es muy importante
en la eliminación de los microorganismos que invaden
la sangre.
CUADRO CLINICO
Sus manifestaciones son muy variables, dependiendo
del tipo de neumococo, de la magnitud del inóculo inicial
y de la edad , características inmunitarias y comorbilidades
del huésped. La neumonía neumocócica es
la principal causa de neumonía adquirida en la comunidad;
representa alrededor del 50-60% de ellas. Afecta a todas las
edades y no hay diferencia de sexo. Frecuentemente va precedida
de una infección viral de las vías respiratorias
superiores. Los ancianos pueden presentar arritmias o descompensación
cardiovascular con signos de insuficiencia cardíaca.
En la radiografía de tórax puede haber consolidación
lobular clásica o consolidación parcial y a menudo
sólo se observa un infiltrado acinar con un patrón
de moteado fino o grueso. Pueden estar afectados uno o más
lóbulos.
En la era preantibiótica, la letalidad
acumulada hasta el cuarto día era aproximadamente de
10% en los casos con bacteremia. Desde el quinto día
en adelante aumentaba rápidamente, alcanzando al 30%
al séptimo día, 60% al décimo y cerca del
80% a los 14 días. En los casos sin bacteremia la letalidad
era menor, con cifras globales entre 40 y 70%.
TRATAMIENTO
El tratamiento con penicilina no modifica la
letalidad de los primeros cinco días, porque en los enfermos
más graves la neumonía produce daños al
comienzo de la enfermedad, antes que alcance a actuar el tratamiento
antibiótico. Este hecho y la observación de que
la letalidad de la neumonía neumocócica bacterémica
se duplica de un 12,5 a un 22,4% si el tratamiento se inicia
al primer o tercer día de la enfermedad, respectivamente,
demuestran que el inicio del tratamiento antibiótico
no puede ser retrasado sin exponer a grave riesgo al paciente.
El Streptococcus pneumoniae es sensible
a la mayoría de los antibióticos en las dosis
usuales. Excepciones importantes son los aminoglucósidos
y algunas quinolonas (ciprofloxacina), motivo por el que no
es recomendable el uso de estos antibióticos como drogas
únicas en neumonías adquiridas en la comunidad.
Aunque el neumococo ha sido bastante sensible a numerosos antibióticos,
en las tres últimas décadas han ido apareciendo
de forma progresiva neumococos resistentes a algunos antibacterianos,
e incluso cepas multirresistentes. El incremento de la prevalencia
de neumococos resistentes a penicilina ha provocado un renovado
interés en la epidemiología de este microorganismo.
La resistencia a antibióticos de Streptococcus
pneumoniae ha ido en aumento en todo el mundo. En Chile,
un tercio de las cepas de S. pneumoniae muestra susceptibilidad
disminuida a penicilina y en cerca de un 20% de los casos la
resistencia es alta. El patrón de resistencia a antimicrobianos
de S. pneumoniae varía según el área
geográfica, población (infantil o adulta) y tipo
de muestras (invasivas y no invasivas) examinados.
A pesar de lo anterior los agentes beta-lactámicos
siguen siendo efectivos y no hay certeza de que exista mayor
riesgo de muerte asociado a la resistencia. Los antimicrobianos
de elección para tratar la neumonía neumocócica
son los agentes beta-lactámicos (penicilina, amoxicilina,
amoxicilina-ácido clavulánico, cefalosporinas
de 2da o 3ra generación). En caso
de alergia, se recomienda prescribir macrólidos (eritromicina,
claritromicina), tetraciclinas o fluoroquinolonas (levofloxacina,
gatifloxacina, moxifloxacina). El tratamiento debe mantenerse
hasta 72 horas después de caída la fiebre y por
lo menos durante cinco días en total.
La vacunación antineumocócica
polivalente ha demostrado ser capaz de reducir el riesgo de
enfermedad neumocócica invasiva (ENI) en sujetos inmunocompetentes
y adultos mayores; sin embargo, no disminuye el riesgo de desarrollar
neumonía ni la letalidad por neumonía. La eficacia
de la vacunación, en la prevención de la ENI,
oscila entre el 53% y 70%. Se recomienda administrar la vacuna
antineumocócica a adultos mayores de 65 años,
pacientes de cualquier edad portadores de enfermedades crónicas
(enfermedades cardiovasculares, respiratorias y renales crónicas,
diabetes mellitus, alcoholismo, daño hepático
crónico, asplenia), e inmunocomprometidos. No obstante,
su utilidad es limitada en algunos de los pacientes en los que
más se necesita, como ser individuos muy comprometidos
en su estado general, ya que en ellos la formación de
anticuerpos se encuentra alterada.
Por ser el agente
causal más frecuente en todas las categorías
de neumonía, el neumococo debe ser cubierto en
todos los esquemas empíricos |
NEUMONIA POR MYCOPLASMA PNEUMONIAE
PATOGENIA
El Mycoplasma pneumoniae ocasiona con
frecuencia infecciones respiratorias adquiridas en la comunidad
en niños y adultos, especialmente infecciones de la vía
aérea superior, traqueobronquitis y neumonías.
Este microorganismo no forma parte de la flora normal de las
vías aéreas, pero puede permanecer en ellas hasta
cinco meses después de una infección. Esta se
adquiere por inhalación de microgotas producidas por
los individuos infectados y es de contagiosidad significativa,
ya que se observan epidemias intrafamiliares o en comunidades
cerradas como colegios e instituciones militares, en individuos
sin alteración aparente de sus mecanismos de defensa.
También se pueden observar epidemias relativamente importantes
en ciudades o países cada 4-7 años. Los estudios
familiares sugieren que la mayoría de las infecciones
por Mycoplasma spp. son sintomáticas.
Una gran proporción se manifiesta como una infección
de vías aéreas superiores y sólo un 3 a
10% presenta el cuadro clínico-radiográfico de
neumonía que, por presentar algunas diferencias con el
producido por el neumococo, inicialmente fue llamado "neumonía
atípica primaria", denominación que hoy se encuentra
en desuso debido a su falta de utilidad para el manejo del caso
individual. La prevalencia de infección por micoplasma
varía según la población examinada y los
criterios diagnósticos empleados. En distintas series,
la prevalencia de neumonía por micoplasma en adultos
ha fluctuado entre 1,9% y 30%.
A diferencia de otros tipos de neumonías,
la causada por micoplasma ocurre con frecuencia en individuos
sin ningún factor predisponente. La mayoría se
presenta en niños e individuos jóvenes, siendo
menos frecuente en menores de 5 años y en ancianos.
Todavía no se conoce con certeza los
mecanismos de virulencia del micoplasma. Actualmente se piensa
que la enfermedad se debe en parte a factores propios del microbio
y en parte a la respuesta inmune que éste desencadena,
ya que existiría alguna similitud entre los antígenos
del micoplasma y los del huésped, lo que induciría
un fenómeno autoinmunitario. Este concepto se apoya,
entre otros hechos, en que los animales de experimentación
y los pacientes con inmunodeficiencia son relativamente resistentes
a desarrollar neumonía por micoplasma.
Los datos anatomopatológicos provienen
de estudios en animales y casos muy graves, generalmente sobreinfectados
con otros microorganismos. Se observan lesiones inflamatorias
bronquiales, peribronquiales y peribronquiolares, con compromiso
del parénquima pulmonar consistente en infiltración
linfocitaria e hiperplasia de neumocitos tipo II, con formación
de membranas hialinas. Inicialmente, las lesiones radiográficas
son de tipo intersticial y progresan hacia un patrón
de relleno alveolar, tienden a ser multifocales o segmentarias,
con marcada preferencia por los lóbulos inferiores. La
intensidad del compromiso alveolar es proporcional a la gravedad
de las manifestaciones clínicas. Si bien el aspecto radiográfico
puede ser sugerente, su especificidad es baja ya que puede observarse
un patrón similar en bronconeumonías bacterianas,
motivo por el cual el diagnóstico no puede estar basado
sólo en la radiografía de tórax.
CUADRO CLINICO
Existe un período de incubación
de dos a tres semanas, después del cual aparecen síntomas
sistémicos y respiratorios variados. El compromiso de
la vía aérea superior se presenta en la mitad
de los casos como odinofagia o síntomas nasales. La tos
es generalmente seca o escasamente productiva, paroxística
y empeora en la noche. La miringitis bulosa (inflamación
del tímpano), considerada como muy sugerente de este
agente, se observa en una minoría de los pacientes. Como
signos de compromiso extrarrespiratorio pueden presentar manifestaciones
cutáneas (exantemas maculopapulares, eritema nodoso,
urticaria, erupciones vesiculares), neurológicas (meningitis
aséptica, ataxia, encefalitis, mielitis transversa) y
síntomas gastrointestinales. El examen pulmonar revela
crepitaciones, pero rara vez existen signos de condensación
pulmonar o de derrame pleural. En pacientes con asma, la infección
puede determinar un aumento de la reactividad bronquial que
incrementa las crisis obstructivas.
En la mayoría de los enfermos la neumonía
por micoplasma tiene una gravedad leve a moderada, por lo que
se dice que el compromiso clínico es mucho menor que
el que sugiere la radiografía de tórax. No obstante,
en algunos pacientes se pueden producir neumonías extensas,
con insuficiencia respiratoria grave y muerte. La letalidad
de la neumonía por micoplasma es difícil de establecer,
ya que muchos episodios leves pasan inadvertidos y se confunden
con una gripe con tos prolongada. No obstante, algunos estudios
muestran que su letalidad es similar a la neumonía neumocócica,
con cifras de aproximadamente un 5%. La explicación para
esta cifra tan alta también podría tener relación
con una subestimación del número total de neumonías
por micoplasma. .
El cultivo del micoplasma requiere de medios
muy complejos, lo que determina que su aislamiento en el laboratorio
sea difícil y demoroso, razones por las cuales este examen
no se utiliza rutinariamente en clínica. En la mayoría
de los pacientes el diagnóstico presuntivo se hace sobre
la base del cuadro clínico-radiográfico y se confirma
mediante serología. El agente causal se puede confirmar
demostrando un aumento de 4 veces en los títulos de anticuerpos
antimicoplasma, lo que demora 2-3 semanas en ocurrir. También
ha sido utilizado como criterio diagnóstico un título
inicial elevado de 1/128 o más. La detección de
anticuerpos IgM en títulos de1/32 o mas permite
realizar un diagnóstico más rápido, pero
el examen tiene algunos problemas de sensibilidad, especialmente
cuando se realiza muy precozmente. Se han desarrollado técnicas
de biología molecular (PCR) para la detección
de antígenos de Mycoplasma spp. en muestras respiratorias
con sensibilidad y especificidad variables, pero la complejidad
del método y su elevado costo han limitado la aplicación
clínica.
La presencia de crioaglutininas se puede documentar
en aproximadamente la mitad de los casos, pero no es específica,
ya que las neumonías virales explican aproximadamente
un 25% de los casos de neumonías con crioaglutininas
positivas. La presencia de estos anticuerpos puede precipitar
una anemia hemolítica, pero ésta se observa sólo
en los escasos pacientes que tienen títulos muy elevados.
TRATAMIENTO
El micoplasma es susceptible a antibióticos
que interfieren la síntesis proteica y de DNA, como los
macrólidos, tetraciclinas, ketólidos y fluoroquinolonas.
El tratamiento con estos agentes acorta el cuadro clínico
pero no disminuye la etapa contagiosa, ya que los pacientes
continúan eliminando el microorganismo hasta por 5 meses.
El tratamiento debe mantenerse por 2 a 3 semanas. La neumonía
por micoplasma confiere sólo una inmunidad parcial, lo
que implica que pueden repetir nuevos episodios que suelen ser
menos intensos.
Cabe sospechar micoplasma
cuando se producen varios casos en un mismo entorno |
NEUMONIA POR GERMENES ANAEROBICOS
PATOGENIA
Los gérmenes anaerobios son habitantes
normales de la cavidad bucal, donde se encuentran en concentraciones
que superan hasta 10 veces la de los gérmenes aerobios.
La concentración de bacterias en la saliva de un sujeto
sano es de 108 bacterias/ml, pero cuando hay enfermedad
periodontal ésta aumenta a 1011 bacterias/ml,
cobrando especial importancia los bacilos anaerobios gramnegativos.
Si se considera que la aspiración de
secreciones bucofaríngeas en pequeñas cantidades
es un hecho normal, resulta evidente que estos microorganismos
son poco virulentos, ya que pueden ser eliminados con facilidad
por los mecanismos defensivos del pulmón. Para que se
produzca una neumonía anaeróbica se necesita que
exista:
a) Un inóculo muy grande, como ocurre en los pacientes
con alteración de conciencia por convulsiones, coma diabético,
anestesia general, trauma craneoencefálico, abuso de
drogas, accidente cerebrovascular o trastornos de deglución.
La sepsis oral aumenta considerablemente el riesgo por
la alta concentración de gérmenes en la boca.
b) Una falla en los mecanismos defensivos locales, como la obstrucción
bronquial en neoplasias pulmonares y las bronquiectasias. Las
alteraciones de los mecanismos defensivos generales parecen
ser poco importantes.
c) Una minoría de casos se produce por
extensión de una infección subfrénica o
por vía hematógena.
Los gérmenes anaerobios tienen pocos
factores de virulencia, lo que dificulta que una especie individual
pueda invadir los tejidos y resistir los mecanismos defensivos
del huésped. Debido a esto, los anaerobios son generalmente
parte de infecciones mixtas La asociación con gérmenes
aerobios facultativos facilita el desarrollo de los anaerobios
al consumir oxígeno. Este sinergismo explicaría
por qué algunas infecciones por anaerobios responden
a un tratamiento antibiótico al que son poco sensibles,
ya que el antibiótico al eliminar los gérmenes
asociados alteraría el medio para el desarrollo de los
gérmenes anaerobios resistentes. Algunos gérmenes
anaerobios poseen cápsulas polisacáridas que funcionan
como factores de virulencia, tanto para resistir la fagocitosis
como actuando como endotoxinas débiles. Otros gérmenes
tienen enzimas capaces de necrosar tejidos, lo que explica la
formación de abscesos y la neumonía necrotizante.
Las bacterias anaerobias tienen propiedades
pro-coagulantes que originan trombosis, como en el caso de Bacteroides
fragilis que produce una heparinasa, que degrada la heparina
endógena, favoreciendo la formación de trombos
que ocluyen la microcirculación pulmonar, conduciendo
a microinfartos y necrosis del parénquima pulmonar.
En el paciente quirúrgico, la neumonía
por aspiración tiene una prevalencia del 0,8%. los factores
que aumentan el riesgo son la edad mayor a 60 años, demencia,
enfermedad pulmonar obstructiva crónica, enfermedad maligna
y admisión de emergencia. Los pacientes con estas características
tienen alta probabilidad de requerir terapia intensiva, mayor
estadía hospitalaria y mortalidad. En el paciente crítico
la posición supina, el reflujo gastroesofágico,
la presencia de sonda nasogástrica, la dismotilidad gastrointestinal
debida a sepsis, trauma, quemaduras, cirugía, shock,
etc., gastroparesia, alimentación enteral, obstrucción
intestinal, uso de inhibidores de la bomba de protones y bloqueadores
H2, constituyen factores de riesgo para
aspiración y desarrollo posterior de neumonía.
Esta infección es polimicrobiana en
60 a 80% de los casos y está
constituida por la flora aerobia y anaerobia habitual de la
orofaringe. Las especies involucradas en una neumonía
son habitualmente múltiples, con un promedio de unas
tres especies de gérmenes anaerobios por caso. . El Bacteroides
fragilis, resistente a varios antibióticos corrientes,
se encuentra sólo en alrededor de 7% de los casos. Además,
en la mitad de los enfermos están implicados gérmenes
aeróbicos, preferentemente bacilos gramnegativos entéricos.
En aspiraciones masivas,
la neumonía se ubica generalmente en las zonas dependientes
en decúbito, tales como los segmentos apical y
basales del lóbulo inferior, y segmentos posteriores
del superior. Cuando existen lesiones obstructivas localizadas,
la neumonía se ubica en el segmento comprometido.
Los conocimientos confiables respecto esta
enfermedad derivan sólo de los estudios en que el diagnóstico
etiológico se ha efectuado mediante endoscopía
y catéter protegido, ya que con otros métodos
la contaminación de muestras por anaerobios es inevitable
y los hemocultivos son positivos sólo en un 3% de los
casos. Algunos estudios sugieren que estos microorganismos serían
la segunda causa de neumonías adquiridas en la comunidad,
ya que se los encontró en un 33% y 22% en dos series
de enfermos hospitalizados en los que se utilizó punción
transtraqueal y catéter telescópico protegido,
respectivamente. La explicación para estas cifras tan
altas sería que con estos métodos invasivos se
pesquisan casos producido por anaerobios que, en su fase inicial,
pueden confundirse fácilmente con una neumonía
neumocócica . Los anaerobios están involucrados
en un tercio de las neumonías intrahospitalarias y en
cerca del 90% de los abscesos pulmonares y neumonías
aspirativas. En los derrames pleurales complicados , los anaerobios
están involucrados entre un 12 a 76% de los casos.
CUADRO CLINICO
El curso de la enfermedad es muy variable,
ya que pueden existir casos de curso subagudo o crónico
que simulan una tuberculosis o neoplasia, y otros de evolución
aguda indistinguibles de una neumonía neumocócica.
La primera fase de la infección, o "neumonitis anaeróbica",
es similar clínica y radiográficamente a una neumonía
neumocócica, aunque como grupo se pueden observar algunas
diferencias:
a) Los pacientes no presentan calofríos intensos (0%
vs 46%).
b) Los pacientes suelen consultar más tardíamente
(4,5 vs 2,6 días).
c) La expectoración puede ser pútrida. Este signo
es muy específico pero es poco sensible, ya que sólo
se observa en una baja proporción de los pacientes .
Si los pacientes son tratados oportunamente
con penicilina en las dosis usuales para S. pneumoniae,
la respuesta clínica es satisfactoria en el 80% de los
casos y sólo un 20% de las neumonías por anaerobios
así tratadas evolucionan hacia un absceso pulmonar. En
los pacientes que demoran más en consultar y en ser tratados,
es corriente la excavación del foco neumónico
por lo que el diagnóstico clínico de neumonía
por anaerobios es generalmente evidente, tanto por el aspecto
radiográfico como por la expectoración pútrida.
La formación de abscesos pulmonares en neumonías
anaeróbicas es lenta, ya que se requieren entre 7 y 16
días para aparecer en la radiografía de tórax.
La excavación puede adoptar dos formas:
a) Múltiples pequeñas cavidades dentro del territorio
afectado, denominada "neumonía
necrotizante".
b) Una gran cavidad o absceso pulmonar.
El curso subagudo de la enfermedad explica
que puedan aparecer alteraciones propias de las enfermedades
crónicas, tales como anemia, hipoalbuminemia y baja de
peso, lo que suele conducir a confusión con tuberculosis
o cáncer bronquial. En los enfermos con abscesos pulmonares,
la velocidad de respuesta al tratamiento es bastante más
lenta que en neumonías no complicadas, con mayor persistencia
de la fiebre y de las lesiones radiográficas, lo que
determina que la duración del tratamiento antibiótico
deba ser prolongada.
El estudio microbiológico en los casos
con sospecha de neumonía por anaerobios se efectúa
pocas veces, ya que la mayoría de estas infecciones responde
al tratamiento empírico con agentes beta-lactámicos
(penicilina, amoxicilina, cefalosporinas 3ra
generación). Por otra parte, cuando la enfermedad se
complica con excavación o empiema, el diagnóstico
clínico es relativamente fácil, lo que lleva también
a un tratamiento con drogas adecuadas, sin necesidad de confirmación
bacteriológica. Por otra parte, la demora para obtener
el desarrollo de gérmenes en el cultivo, que puede llegar
a ocho días, limita su utilización clínica.
Cuando se desea demostrar esta etiología, las muestras
más apropiadas son el catéter telescópico
y el lavado broncoalveolar.
TRATAMIENTO
La letalidad, que en la era preantibiótica
era cercana a un tercio, ha disminuido a cifras cercanas al
10%. Aun cuando aproximadamente el 50% de los B. melaninogenicus
y 93% de los B. fragilis son resistentes a penicilina,
esta droga continúa siendo el tratamiento de elección,
ya que los estudios clínicos demuestran que sus resultados
a largo plazo son similares a los obtenidos con otros agentes
más costosos y tóxicos. Esto se debería
a la sinergia con otros gérmenes ya explicada en la patogenia
de la enfermedad. No obstante, dado que la respuesta clínica
con clindamicina es más rápida que la que se observa
con penicilina, se acepta actualmente que la primera es la droga
de elección en casos graves o en aquellos con respuesta
retardada a penicilina. . El metronidazol es activo contra el
Bacteroides fragilis, pero no lo es contra varias otras
especies que causan neumonía, y es menos activo que la
clindamicina en el tejido pulmonar, por lo que se considera
un régimen de segunda elección.
En los casos de abscesos pulmonares o neumonías
necrotizantes, se recomienda administrar penicilina en dosis
elevadas (12 millones U al día), clindamicina 600 mg
cada 8 horas o metronidazol 500 mg cada 8 horas, vía
endovenosa, mientras existan evidencias clínicas de enfermedad
activa, como fiebre, compromiso del estado general, anorexia,
etc. Una vez que el cuadro clínico ha remitido, se recomienda
continuar con dosis bajas de penicilina oral (1 millón
U cada 6-8 horas) o amoxicilina (1 g cada 8 horas), durante
2 a 4 meses, hasta que la radiografía demuestre desaparición
o estabilización de las lesiones pulmonares. Los tratamientos
demasiado cortos conducen a recaídas. En casos en que
se haya comprobado una infección concomitante por gérmenes
aerobios o éstos se sospechen por la gravedad del paciente,
es conveniente cubrir con el antibiótico apropiado.
La utilización terapéutica del
aseo broncoscópico en los abscesos pulmonares ha sido
abandonada. El examen broncoscópico está justificado
sólo en los pacientes en quienes se sospecha una neoplasia
o para obtener muestras para identificación de gérmenes
aerobios que estén involucrados en la infección.
Los principales índices de sospecha de cáncer
son la falta de otros factores predisponentes para desarrollar
neumonías por anaerobios y un cuadro clínico con
escasas manifestaciones infecciosas. El tratamiento quirúrgico
de los abscesos pulmonares se considera actualmente sólo
en casos excepcionales, principalmente en relación con
hemoptisis masivas. En los empiemas es necesario efectuar siempre
alguna forma de drenaje o evacuación del espacio pleural.
Cuando se produce retraso en la resolución de un absceso
pulmonar puede considerarse el uso de drenaje percutáneo
de la cavidad mediante un catéter.
|
Siempre que exista riesgo o
evidencias de aspiración debe considerarse esta
etiología
|
NEUMONIA POR GERMENES GRAMNEGATIVOS
PATOGENIA
Los bacilos gramnegativos aeróbicos
son, en su mayoría, capaces de vivir en el medio ambiente,
tanto en el suelo como en el agua y muchos de ellos pueden colonizar
el intestino humano sin producir enfermedad. La colonización
de la cavidad oral es poco frecuente en los individuos con inmunidad
normal, pero aumenta en cualquier enfermedad que altere en forma
significativa las condiciones generales de un paciente por lo
que este fenómeno es especialmente notorio en los enfermos
hospitalizados, en los que puede llegar a presentarse en el
80%. La colonización por gramnegativos se observa también
en pacientes con enfermedades graves que viven en su casa o
en centros geriátricos, como también en alcohólicos
y diabéticos. Estas observaciones demuestran que la mayor
colonización por estos gérmenes no se debe sólo
a fallas intrahospitalarias en el control de la transmisión
de infecciones, sino que tiene estrecha relación con
las condiciones intrínsecas del paciente. En el personal
de hospital y en pacientes hospitalizados sin enfermedades graves
colonización por gramnegativos es similar a la de la
población general .
Una situación especial es la de la
Pseudomonas aeruginosa, microorganismo altamente resistente
a los desinfectantes que se multiplica en los ambientes húmedos
del hospital, tales como lavatorios, jabón, soluciones
"desinfectantes", nebulizadores y respiradores. Los pacientes
con compromiso de su sistema inmunitario expuestos a este ambiente
tienen una alta probabilidad de contraer neumonías
por este germen. Esto explica que en la mayoría de las
series clínicas los gérmenes gramnegativos ocasionen
más de la mitad de las neumonías adquiridas en
el hospital y que sólo causen una baja proporción
(2-5%) de las neumonías adquiridas en la comunidad.
Existen muchas especies de microorganismos
gramnegativos y muchas de ellas son capaces de producir enfermedad,
aunque sólo algunas se observan con frecuencia significativa.
En esta parte describiremos sólo las características
comunes, haciendo referencia a las particularidades de las neumonías
causadas por los gérmenes más frecuentes, cuando
sea pertinente.
La neumonía por Klebsiella pneumoniae
es la más frecuente de las adquiridas en la comunidad
causadas por gérmenes gramnegativos . Se produce casi
siempre por aspiración de secreción orofaríngea
en individuos altamente colonizados. Ocurre con mayor frecuencia
en sujetos con padecimientos debilitantes, en alcohólicos,
portadores de enfermedades respiratorias crónicas y en
inmunosuprimidos. Con menor frecuencia se observan infecciones
por Pseudomonas aeruginosa, Escherichia coli, Enterobacter
spp., Proteus mirabilis, Citrobacter spp., Acinetobacter calcoaceticus
y Serratia marcescens. Las neumonías provocadas
por otros gérmenes gramnegativos, tales como Haemophilus
influenzae y Legionella pneumophila son tratadas
en otra parte de este capítulo.
Muchos bacilos gramnegativos tienen fimbrias
o pili que les permiten unirse específicamente
a receptores de la mucosa respiratoria. Estos receptores no
están accesibles en condiciones normales, pero sí
cuando existen alteraciones bioquímicas o estructurales
de la mucosa que los ponen al descubierto, permitiendo así
la colonización. La principal característica común
de los gérmenes gramnegativos es su capacidad para producir
endotoxinas, que son lipopolisacáridos que forman parte
de la pared celular de las bacterias y que son capaces de producir
múltiples efectos biológicos cuando se inyectan
experimentalmente en animales. Entre éstos cabe mencionar
la producción de fiebre, activación del complemento,
activación del factor de Hageman, vasodilatación,
aumento de la permeabilidad vascular, shock, etcétera.
Además, algunos gramnegativos como Klebsiella spp.
poseen cápsulas que, de manera similar al S. pneumoniae,
son capaces de proteger al germen de la fagocitosis. Por otra
parte, la P. aeruginosa es capaz de producir una exotoxina
que tiene estructura similar a la toxina diftérica, cuya
acción está dirigida preferentemente contra el
hígado. Varios bacilos gramnegativos son capaces de producir
vasculitis pulmonar y también necrosis, con formación
de abscesos y empiemas.
CUADRO CLINICO
El cuadro clínico es, en general, el
de una neumonía bacteriana de extrema gravedad con rápida
progresión del compromiso sistémico, por lo que
muchos de estos enfermos se encuentran en shock en el momento
del diagnóstico. Debido a la producción de endotoxinas
y al shock, es posible que se observe un edema pulmonar no cardiogénico
por trastorno de la permeabilidad alveolocapilar (síndrome
de distrés respiratorio agudo) que compromete aun más
la función pulmonar, con insuficiencia respiratoria aguda
grave.
No todas las neumonías por gramnegativos
tienen curso clínico grave, ya que en algunos casos de
neumonía por Klebsiella spp. y en la mayor parte
de las escasas neumonías por Proteus spp. el cuadro
clínico es subagudo, con compromiso progresivo del estado
general, tos productiva, expectoración purulenta o hemoptoica,
lo que sumado al aspecto radiográfico, puede simular
una tuberculosis pulmonar.
Los hallazgos del examen físico son
inespecíficos y variables, dependiendo de la gravedad
y la magnitud de la condensación pulmonar y el compromiso
pleural. Las alteraciones del hemograma son también inconstantes,
ya que se puede observar desde leucocitosis marcada a recuentos
normales o leucopenia, que es un índice de gravedad.
La radiografía de tórax puede
mostrar diferentes alteraciones, tales como una condensación
homogénea no segmentaria, similar a la que se observa
en una neumonía neumocócica, un patrón
de bronconeumonía, como el de una infección estafilocócica,
o un patrón de nódulos múltiples, por diseminación
hematógena similar al observado en los abscesos piohémicos
estafilocócicos (Figura 30-1).
En casos muy graves se suele observar una
condensación que compromete totalmente ambos pulmones,
probablemente debido a edema pulmonar de permeabilidad agregado
a la inflamación por la infección. Aunque se ha
descrito como típico de la neumonía por Klebsiella
el compromiso lobular con aumento de volumen (Figura 29-3),
este signo no es específico, ya que también puede
estar presente en neumonías causadas por otros agentes.
La mayoría de las infecciones por gramnegativos que sobreviven
el tiempo suficiente, tienden a producir excavación,
con formación de abscesos pulmonares. El compromiso pleural
se observa en aproximadamente la mitad de los casos y puede
evolucionar hacia la producción de pus o empiema. En
las formas crónicas, producidas por Klebsiella o
Proteus spp., la radiografía de tórax puede
ser muy similar a la de una tuberculosis con un infiltrado excavado
en el lóbulo superior .
Todos los gérmenes gramnegativos mencionados
crecen con facilidad, por lo que son fácilmente identificables
en cultivo. No obstante, la interpretación de un examen
microbiológico de expectoración con abundantes
bacilos gramnegativos debe ser cautelosa, ya que si la muestra
no ha sido procesada rápidamente el gran número
de gérmenes puede corresponder a la multiplicación
in vitro del microorganismo en la muestra de expectoración,
o si el paciente ha recibido antibióticos puede tratarse
de colonización por eliminación de la flora normal
sin que los gramnegativos tengan un rol patogénico. La
bacteremia se presenta en aproximadamente un 25% de los casos,
por lo que siempre deben obtenerse hemocultivos en
los pacientes con neumonías graves. Dada la gravedad
de los pacientes con neumonías por gramnegativos y su
variable patrón de resistencia a los antimicrobianos,
en algunos de estos enfermos está indicado efectuar exámenes
invasivos que permitan identificar el agente causal y obtener
su sensibilidad a los antibióticos.
TRATAMIENTO
Idealmente, el tratamiento de las neumonías
por bacilos gramnegativos debe efectuarse conociendo la susceptibilidad
del microorganismo implicado, ya que suelen ser resistentes
a múltiples antibióticos. Debido a diferencias
locales en el uso de antibióticos, la resistencia de
las cepas es variable en distintas instituciones, por lo que
el diseño de tratamientos empíricos debería,
también idealmente, efectuarse sobre la base de los resultados
de exámenes microbiológicos de cada centro. Considerando
la extrema gravedad de estas neumonías, las drogas deben
utilizarse por vía endovenosa y en dosis elevadas. El
tratamiento debe prolongarse por lo menos por dos semanas, ya
que lapsos menores se asocian a recaídas. Para algunos
microorganismos es recomendable el uso de combinaciones de antibióticos
que actúan sinérgicamente (P. aeruginosa).
El pronóstico de las neumonías
por gramnegativos es malo, tanto por la gravedad determinada
por la enfermedad como por las condiciones predisponentes. Con
tratamiento apropiado las neumonías por Klebsiella
spp. aún tienen una letalidad de 20 a 50%, y las
ocasionadas por Pseudomonas spp., de 50 a 80%.
|
Ante la existencia de condiciones
ambientales o personales que faciliten la colonización
de la vía aérea por gramnegativos debe considerarse
esta alternativa. |
NEUMONIA ESTAFILOCOCICA
PATOGENIA
Los estafilococos son microorganismos muy bien
adaptados para convivir con el hombre, por lo que es frecuente
la colonización de diferentes sitios del organismo, especialmente
nariz, zona perineal y piel. El estado de portador nasal se
puede observar hasta en un 30% de la población. La mayoría
de ellos lo son transitoriamente (60%), aunque también
existen portadores permanentes (20%). Mientras sólo el
10-20% de los adultos sanos están colonizados con S.
aureus, el riesgo de colonización persistente aumenta
en los pacientes con dermatitis atópica (hasta 85%),
pacientes quirúrgicos, en hemodiálisis crónica,
portadores de VIH o de dispositivos intravasculares. El personal
de salud tiene mayor riesgo de colonización con S.
aureus al entrar en contacto con pacientes colonizados,
y puede ser el vehículo de transmisión de la infección
a otros pacientes. Los estafilococos causan una escasa proporción
de las neumonías extrahospitalarias, lo que demuestra
que en condiciones normales las defensas naturales son capaces
de evitar la infección. Para que ésta se produzca
se necesita una alteración de los mecanismos defensivos,
bastando que sea de moderada magnitud. La más frecuente
es la infección por virus influenza A, que, por una parte,
aumenta la adherencia del microorganismo a las células
bucofaríngeas y, por otra, altera el funcionamiento de
sistema mucociliar, descamando el epitelio respiratorio, lo
que además facilita la penetración del germen.
Otras condiciones que incrementan el riesgo de infección
estafilocócica son las enfermedades crónicas como
diabetes o granulocitopenia, así como las edades extremas.
Por otra parte, el ambiente intrahospitalario favorece la transmisión
de Staphylococcus spp., la que se produce especialmente
por contacto directo con personal portador del germen. Por esta
razón, si no se toman precauciones, una considerable
proporción de las neumonías intrahospitalarias
pueden ser causadas por este microorganismo. El S. aureus
ocasiona alrededor del 20-30% de los episodios de neumonía
nosocomial y 30-40% de los casos de neumonía asociada
a respiración mecánica. La emergencia de cepas
de S. aureus resistentes a meticilina ha aumentado en
las infecciones adquiridas en la comunidad y especialmente en
las infecciones nosocomiales.
CUADRO CLINICO
El S. aureus puede producir neumonía
a través del mecanismo de aspiración de secreciones
y también por vía hematógena. En la neumonía
estafilocócica adquirida por aspiración, el foco
inicial se ubica corrientemente en las vías aéreas,
desde donde se disemina hacia el parénquima pulmonar
adyacente produciendo, por lo tanto, una condensación
de tipo segmentario o bronconeumónica. Debido a que las
vías aéreas comprometidas están llenas
con exudado, suele no haber broncograma aéreo y existe
tendencia a las atelectasias. Si bien la neumonía puede
comprometer un solo lóbulo, lo más frecuente es
el compromiso multilobar, con tendencia a progresar velozmente.
El compromiso bilateral se observa en aproximadamente un 60%
de los casos. Las neumonías estafilcócicas hematógenas,
en cambio, tienen un patrón de nódulos metastásicos
múltiples . Este aspecto radiográfico, en el contexto
de una sepsis, es altamente sugerente del origen estafilocócico
de la neumonía.
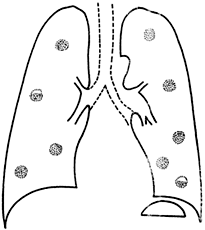
Figura 30-1. Nódulos
múltiples, dos de ellos excavados, en una séptico-piohemia
estafilocócica. Este patrón radiográfico
puede ser también producido por algunos gram negativos,
infecciones crónicas por hongos y causas no infecciosas,
como metástasis neoplásicas
Una de las características principales
del S. aureus es su capacidad de producir necrosis tisular,
probablemente debido a las múltiples enzimas y exotoxinas
que el germen es capaz de liberar al medio. Por ello, las neumonías
estafilocócicas suelen excavarse, causando abscesos pulmonares
(25-75%), y tienden a comprometer la pleura, produciendo derrames
pleurales paraneumónicos o empiemas (50%). En los niños
es frecuente la aparición de neumatoceles, que son cavidades
pulmonares de paredes delgadas que se producirían por
insuflación de un absceso, debido a que el compromiso
bronquial generaría mecanismos de válvula que
permiten al aire entrar pero no salir (Figura 30-2). Probablemente
por mecanismos similares puede romperse una cavidad hacia el
espacio pleural, produciéndose un pioneumotórax.
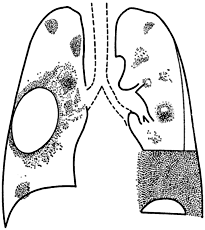
Figura 30-2. Diferentes lesiones radiográficas
en neumonías estafilocócicas. A la derecha
se ve un neumatocele y a izquierda, al centro, un absceso
y abajo un pioneumotórax.
En las muestras respiratorias obtenidas apropiadamente,
el estafilococo puede tener su aspecto característico
de cocáceas grampositivas en racimos en las
placas de cultivos , pero en la tinción de Gram suelen
observarse como cocáceas aisladas, en cadenas o en diplo,
lo que puede inducir a errores de interpretación de .
El estafilococo se cultiva con facilidad en las muestras respiratorias
adecuadas, por lo que su ausencia en pacientes sin tratamiento
antibiótico hace poco probable este agente. En los pacientes
que han recibido tratamiento antibiótico antes de tomar
la muestra de expectoración, los cultivos pueden ser
falsamente positivos para estafilococos. Los hemocultivos son
positivos en hasta un 50% de los casos, por lo que siempre deben
ser efectuados en los casos graves. Se han desarrollado nuevas
técnicas de biología molecular (PCR) para la identificación
de S. aureus resistente a meticilina, especialmente útiles
en infecciones bacterémicas y evaluación de portadores
nasales.
El cuadro clínico en la mayoría
de los pacientes es el de una neumonía bacteriana grave.
Como características especiales están la tendencia
a producir múltiples episodios de calofríos y
la presencia frecuente de expectoración hemoptoica. No
obstante, el cuadro clínico también puede ser
el de una neumonía subaguda, con moderado compromiso
del estado general, evolución que ha sido descrita con
mayor frecuencia en pacientes que adquieren su neumonía
en el hospital. El examen físico es muy variable e inespecífico.
Dependiendo del tipo de lesiones presentes, puede o no haber
signos francos de condensación o de derrame pleural.
Como complicación es posible observar abscesos metastásicos,
que suelen localizarse en cerebro y riñón.
TRATAMIENTO
Debido a su gran variabilidad genética,
el estafilococo es capaz de adquirir rápidamente resistencia
a los antibióticos. Actualmente la mayoría de
las cepas son productoras de betalactamasa y, por lo tanto,
resistentes a penicilina. Debido a esto, el tratamiento de elección
es la cloxacilina, la que debe administrarse en dosis elevadas
(6-8 g/día) y prolongarse por tres semanas por lo menos.
En casos en que exista resistencia a las penicilinas semisintéticas,
debe cambiarse el tratamiento a vancomicina, teicoplanina, linezolid
o una combinación de eritromicina (reemplazable por clindamicina
o lincomicina) con rifampicina o fosfomicina. El pronóstico
es malo aun con tratamiento antibiótico apropiado, ya
que la letalidad es del orden de 30-40% de los casos, hecho
que está también relacionado con la gravedad de
la enfermedad y las condiciones predisponentes.
|
Esta etiología debe ser sospechada en toda neumonía
nosocomial o asociada a influenza. |
NEUMONIA POR HAEMOPHILUS INFLUENZAE
PATOGENIA
El Haemophilus influenzae es un cocobacilo
gramnegativo que coloniza la faringe en un tercio de los adultos
sanos y un porcentaje mayor en los niños. La frecuencia
de colonización aumenta en relación con las
infecciones virales y con la bronquitis crónica de
los fumadores, en los cuales se lo encuentra en más
del 60% de los casos. Existen dos tipos de Haemophilus
spp.:
a) Los capsulados, que tienen la capacidad de invadir el torrente
sanguíneo y, por lo tanto, tienden a producir enfermedades
muy graves, tales como meningitis, artritis y neumonías
fulminantes.
b) Los no capsulados, que son los que con mayor frecuencia
colonizan las vías aéreas y producen otitis
media en niños e infecciones respiratorias bajas en
pacientes senescentes o con enfermedad pulmonar obstructiva
crónica (EPOC).
La incidencia de infecciones por Haemophilus
spp. está probablemente subestimada, ya que para
cultivarlos se requieren métodos bacteriológicos
especiales. Por otra parte, estos microorganismos son poco
resistentes a las condiciones ambientales, razón por
la cual no se desarrollan si la muestra no es sembrada de
inmediato. El aspecto con la tinción de Gram, de cocobacilos
gramnegativos, es característico, lo que permite sospechar
el diagnóstico cuando el germen se observa en abundancia.
Las cepas de Haemophilus capsulados,
especialmente los de tipo b, son los responsables de la mayor
parte de las infecciones invasivas, debido a que la cápsula
le confiere una resistencia a la acción del complemento.
Por otra parte, los lipopolisacáridos de la superficie
bacteriana de las cepas no capsuladas paralizan los cilios
respiratorios, lo que facilita su adherencia. Además,
el Haemophilus tiene una extraordinaria capacidad para
producir una enzima específica para destruir la IgA
humana, hecho que probablemente tiene relación con
su virulencia.
CUADRO CLINICO
La neumonía por Haemophilus spp.
se observa sólo excepcionalmente en individuos
previamente sanos. La gran mayoría presenta factores
predisponentes como EPOC alcoholismo, diabetes, esplenectomía,
SIDA o defectos inmunológicos específicos. El
cuadro clínico-radiográfico es el de una neumonía
bacteriana, sin elementos característicos. La imagen
radiográfica es la de una neumonía con relleno
alveolar, que puede tener patrón segmentario o no segmentario,
con foco único o focos múltiples. La excavación
es infrecuente. El derrame pleural se presenta en aproximadamente
la mitad de los casos. La neumonía causada por Haemophilus
capsulado tipo b es habitualmente fulminante y de extrema
gravedad. La letalidad es alta, del orden del 30% , probablemente
debido a la gravedad de los factores predisponentes. En contraste,
la neumonía por gérmenes no capsulados se suele
diagnosticar por cultivo de expectoración, ya que rara
vez es bacterémica, evoluciona sin complicaciones y
su letalidad es baja.
TRATAMIENTO
Alrededor de un 20-35% de las cepas son productoras
de beta-lactamasa, lo que les
confiere resistencia a ampicilina y amoxicilina. La mayoría
de las cepas son susceptibles a las combinaciones de ampicilina-sulbactam
y amoxicilina-ácido clavulánico, cloranfenicol,
fluoroquinolonas, nuevos macrólidos y cefalosporinas
de 2da y 3ra generación.
El hemófilo se asocia
especialmente a defensas disminuidas y a EPOC. |
NEUMONIAS VIRALES
Las consideraciones generales respecto a enfermedades
virales, desarrolladas en el capítulo de infecciones
de las vías aéreas superiores, son aplicables
a la patogenia de las neumonías virales. Algunas de éstas
pueden formar parte de un cuadro general fácilmente reconocible,
como sarampión o varicela. Otras en cambio tienen pocas
manifestaciones específicas, por lo que su diagnóstico
sólo puede sospecharse por la presencia de una epidemia
en la comunidad y confirmarse mediante estudios serológicos,
cultivos celulares específicos o detección de
antígenos virales con técnicas de amplificación
de ácidos nucleicos.
PATOGENIA
Al igual que las bacterias, algunos virus son
capaces de causar neumonías en individuos con inmunidad
normal (influenza, parainfluenza, adenovirus, sincicial respiratorio),
mientras que otros solamente lo hacen en enfermos con inmunodepresión
(citomegalovirus, herpes).
Las neumonías virales más frecuentes
en adultos son ocasionadas por virus influenza, que causan aproximadamente
un 10% de las neumonías adquiridas en la comunidad, afectando
especialmente a los individuos más jóvenes, aunque
las epidemias comprometen a individuos de todas las edades y
son más graves en niños y ancianos. Por otra parte,
debe tenerse presente que si bien las neumonías virales
pueden presentarse en individuos jóvenes previamente
sanos, lo habitual es que afecten con mayor intensidad a pacientes
con inmunodepresión celular (enfermedades hematológicas,
quimioterapia, trasplantes, infección por VIH/SIDA)..
En éstos se observa, además, neumonías
por citomegalovirus y virus herpes, que rara vez causan infecciones
significativas en adultos sin compromiso inmune. En niños,
los virus más importantes son el adenovirus y el virus
sincicial respiratorio, ya que producen neumonía y bronquiolitis
graves, con secuelas importantes.
Dada la demora que tienen los exámenes
serológicos y los cultivos, el diagnóstico de
las neumonías virales es generalmente presuntivo, basado
en el cuadro clínico y en el antecedente de enfermedades
similares en otros miembros de la familia o en la comunidad.
No obstante, con los métodos modernos de ingeniería
genética, actualmente está siendo posible efectuar
diagnósticos rápidos, cuya utilidad aumentará
en la medida que aparezcan tratamientos antivirales eficaces.
Por otra parte, algunos virus como el citomegalovirus, el adenovirus
y el virus herpes producen alteraciones citopáticas relativamente
características, que permiten presumir fundadamente la
etiología de una neumonía en muestras histológicas
y citológicas.
Los virus capaces de producir neumonías
son los virus influenza, adenovirus, virus parainfluenza, virus
sincicial respiratorio, virus varicela-zóster, virus
herpes, virus del sarampión, citomegalovirus, virus Coxsackie,
Echovirus, rinovirus, reovirus y virus de Epstein-Barr. Se dispone
de tratamiento específico sólo para algunos patógenos
virales, como virus influenza, varicela-zóster, herpes
y citomegalovirus. . A continuación analizaremos la infección
por virus influenza, que puede considerarse como el prototipo
de neumonía viral y es, además, la más
frecuente en adultos y el compromiso pulmonar por virus Hanta
cuyo diagnóstico precoz es la única manera de
mejorar parcialmente su pésimo pronóstico.
NEUMONIA POR VIRUS INFLUENZA
El virus influenza A es un microorganismo que
cambia fácilmente por mutación, lo que hace posible
que se observen varias infecciones a lo largo de la vida de
un individuo. Cuando las modificaciones del virus son muy importantes,
lo que implica la existencia de un gran número de susceptibles,
se producen las grandes epidemias, como las ocurridas en nuestro
país en 1957, 1968, 1976, 1996 y 2009. Aproximadamente
cada 80 años ocurren pandemias que afectan la mayor parte
del globo, debidas a mutaciones mayores. El virus C, en cambio,
es genéticamente estable, por lo que produce sólo
un episodio de infección en la vida, que generalmente
es de escasa intensidad y el virus B puede presentar modificaciones
genéticas que hacen posible más de una infección
en la vida y causa una enfermedad de intensidad intermedia entre
los virus A y C.
La infección produce habitualmente inflamación
de las vías aéreas superiores que se extiende
rápidamente, alcanzando hasta los bronquíolos,.
lo que ha sido demostrado con biopsias endoscópicas en
voluntarios y anatomopatológicas en animales . En la
necropsia de las personas que fallecen por neumonía debido
a virus influenza A, se observa necrosis con hemorragias de
la mucosa respiratoria, edema intersticial e intraalveolar,
con formación de membranas hialinas, infiltración
intersticial de tipo mononuclear e hiperplasia de neumocitos
tipo II.
La enfermedad comienza generalmente en forma
brusca, con cefalea, calofríos, síndrome febril
y dolores musculares. El compromiso respiratorio puede aparecer
uno o dos días después de iniciado el cuadro,
evidenciado como dolor faríngeo, rinorrea y estornudos.
Puede haber síntomas abdominales y algunas manifestaciones
neurológicas. Posteriormente aparece tos seca y dolor
traqueal. En los casos con neumonía suele haber disnea.
El examen físico puede ser normal o mostrar escasas crepitaciones.
Los signos de condensación francos deben hacer pensar
en una neumonía bacteriana agregada. Los hallazgos radiográficos
son inespecíficos y variables, ya que puede mostrar compromiso
intersticial y/o infiltrados alveolares. En las neumonías
graves suele haber condensación completa de ambos pulmones.
En los casos con condensaciones lobulares o segmentarias, y
en los que el hemograma muestre leucocitosis, debe sospecharse
una sobreinfección bacteriana. El diagnóstico
etiológico es generalmente presuntivo y basado en la
existencia de un brote epidémico.
La amantadina, rimantadina y los inhibidores
de la neuraminidasa (oseltamivir, zanamivir) son útiles
tanto para prevenir la influenza A como para disminuir la intensidad
y duración de los síntomas en los casos sin neumonía.
Desgraciadamente, estas drogas parecen no influir en la evolución
de las neumonías graves por virus influenza A. Las vacunas
contra las cepas prevalentes de virus influenza A y B se obtienen
anualmente y se recomienda usarlas en los individuos más
susceptibles, tales como adultos mayores de 65 años,
pacientes con cardiopatías crónicas, enfermedades
respiratorias crónicas, nefropatías, daño
hepático crónico, diabéticos e inmunocomprometidos.
Esta posibilidad debe tenerse
siempre presente en brotes epidémicos de influenza |
SINDROME PULMONAR POR HANTAVIRUS
En autopsias se comprobado un componente de inflamación
alveolar y el cuadro clínico inicial suele parecer el
de una influenza complicada por neumonitis , pero lo grave y
esencial de esta condición es el compromiso vascular
del pulmón con edema de permeabilidad de muy mal pronóstico
(Distress respiratorio del adulto, capitulo 55). Esta
afección que se empezó a diagnosticar en Chile
en la decada de los 2090 debe tenerse presente porque
lo único que logra reducir su mortalidad es un diagnostico
precoz con aplicación de medidas de apoyo cardiopulmonar
en una unidad de tratamiento intensivo.
En Chile el principal reservorio del virus es el ratón
colilargo, que se distribuye desde la tercera hasta la undécima
región y cuyo hábitat es predominantemente silvestre
en terrenos con malezas y arbustos . El contagio humano se produce
al trabajar
o acampar en zonas de riesgo e través de inhalación
de saliva y excretas del ratón secas o por contacto,
directo o indirecto con ellas (contaminación de terreno,
casas o bodegas deshabitadas, herramientas , líquidos
, alimentos contaminados, etc.)
El período de incubación más frecuente
es de una a tres semanas, pero que puede ser de tres días
a seis semanas. La sintomatología inicial es parecida
a la de la influenza y , cuando se agrega síndrome pulmonar,
aparecen disnea e hipotensión de instalación brusca
y progresión rápida que pueden evolucionar hacia
la insuficiencia respiratoria severa y el shock cardiogénico
refractario, con una mortalidad alrededor del 50% .
Dada la inespecificidad de sus síntomas su diagnóstico
exige tener un alto índice de sospecha y se recomienda
la siguiente conducta:
• Considerar el diagnóstico ante síntomas
sugerentes de influenza + antecedentes de riesgo como exposición
laboral o recreacional en áreas
rurales, posibilidad de contacto directo o indirecto con ratones
colilargos o sus excretas, etc.
• Investigar la posibilidad con:
o Hemograma: tipo infeccioso con plaquetopenia (<150,000)
, hemoconcentración (hematocrito> 50%) e inmunoblastos(linocitos
alterados)
o Radiografía de tórax si el hemograma es sugerente
o hay disnea :infiltrado intersticial
• Hospitalizar en establecimiento que cuente con Tratamiento
Intensivo , notificar a autoridad sanitaria y confirmar el diagnóstico
con examen de sangre específico en Instituto de Salud
Pública o Universidades Austral y Católica
NEUMONIA POR PNEUMOCYSTIS JIROVECI
PATOGENIA
La neumonía por Pneumocystis jiroveci
persiste como una de las infecciones oportunistas de mayor
prevalencia en pacientes infectados con el virus de inmunodeficiencia
humana (VIH). Descrito hace aproximadamente cien años
como un protozoo, fue reclasificado en 1988 como un hongo.
El análisis de DNA demostró una gran diversidad
de especies de Pneumocystis en una estrecha relación
huésped-especie. Es así como se demostró
que la especie que ocasiona neumonía en humanos correspondía
al P. jiroveci, descrito en 1999.
El Pneumocystis jiroveci es un hongo
que coloniza a la mayoría de los seres humanos, como
lo evidencia la presencia de anticuerpos en más del
70% de los individuos normales. Además se le encuentra
en varias especies de animales domésticos. La enfermedad
se produce en pacientes con grave compromiso de su inmunidad
celular, tales como enfermos con SIDA o que reciben drogas
inmunosupresoras como terapia antirrechazo de trasplantes
o por tratamiento de neoplasias. Con menor frecuencia puede
observarse en lactantes desnutridos, enfermos con linfomas
y en pacientes con tratamiento esteroidal crónico.
La neumonía por Pneumocystis es la primera enfermedad
grave que se manifiesta en muchos pacientes con infección
por VIH, pero su incidencia ha declinado en forma significativa
con la implementación de la terapia antirretroviral
altamente activa (HAART). A pesar de estos avances, el Pneumocystis
permanece como el patógeno oportunista más
importante en personas infectadas por VIH que no reciben o
no responden al HAART, y en aquellos que ignoran su condición
de infectados. Se estima que un 60% de los pacientes VIH positivos
siguen infectándose por este agente en el transcurso
de su enfermedad. El modo de transmisión se desconoce,
pero se supone que la enfermedad se produce por activación
de microorganismos latentes adquiridos previamente.
CUADRO CLINICO
El inicio de la enfermedad es solapado, con
disnea y tos seca. Puede haber fiebre y adenopatías
generalizadas. El examen pulmonar muestra pocas alteraciones
y es posible que la radiografía de tórax sea
normal en casos con compromiso pulmonar inicial, aunque ya
exista disnea e hipoxemia. En los exámenes de laboratorio
destaca la LDH sérica elevada, que es muy sensible
en presencia de Pneumocystis, pero poco específica,
por lo que tiene un valor limitado para el diagnóstico.
El hallazgo más frecuente en la radiografía
de tórax es un compromiso intersticial de predominio
perihiliar bilateral, que se va haciendo difuso y más
homogéneo. También puede existir compromiso
de tipo alveolar o mixto con opacidades reticulares o nodulillares
tenues o áreas de consolidación irregular mal
definidas. En un 15% de los pacientes la radiografía
de tórax es normal. La mayoría de los enfermos
tiene leucocitosis moderada y existe inversión de la
relación linfocitos T ayuda/supresores.
Sin tratamiento, la
enfermedad progresa hacia una condensación completa
de ambos pulmones, con muerte por insuficiencia respiratoria.
El uso de altas dosis de cotrimoxazol o pentamidina permite
disminuir la letalidad a aproximadamente 50% . El agregado
de corticoides en los casos graves permite bajar +esta
cifra hasta aproximadamente 20%, revelando que probablemente
alguna reacción inmunitaria del huésped es importante
en la patogenia de la neumonía. La mortalidad en pacientes
con SIDA complicados con neumonía por Pneumocystis
jiroveci oscila entre un 10-20%, durante el período
inicial de la infección, pero se ve incrementada si
los pacientes llegan a la unidad de cuidados intensivos. En
más de la mitad de los casos de neumonías por
Pneumocystis se puede demostrar una infección
concomitante por citomegalovirus. El diagnóstico puede
hacerse mediante identificación del microorganismo
con tinciones especiales, inmunofluorescencia, anticuerpos
monoclonales o técnicas de biología molecular
(PCR) en expectoración inducida o lavado broncoalveolar
(sensibilidad cercana al 100%). Las biopsias pulmonares transbronquiales
o por toracotomía son raramente necesarias.
El fármaco de elección para
el tratamiento y la quimioprofilaxis de la infección
por P. jiroveci en población de riesgo es el
trimetoprim-sulfametoxazol, aunque han comenzado a aparecer
cepas resistentes a este antimicrobiano.
Este oportunista debe considerarse
si hay una deficiencia inmunitaria importante |
NEUMONIA POR CLAMIDIAS
Las clamidias son microorganismos muy pequeños,
parásitos intracelulares obligados, que actualmente son
considerados bacterias. Pueden causar enfermedades en múltiples
especies de animales, las que actuarían como un reservorio.
La Chlamydia trachomatis produce infección sexual,
conjuntivitis y neumonías en recién nacidos.
En adultos existen dos especies capaces de
causar neumonías: la Chlamydia psittaci y la Chlamydia
pneumoniae.
La Chlamydia psittaci se transmite de
las aves al hombre, aunque también se ha descrito contagio
entre seres humanos. Los primeros casos reconocidos implicaron
aves del orden psitaciformes (loros, catitas, etc.), por lo
que la enfermedad fue denominada psitacosis. Posteriormente
se reconoció que otras aves también pueden estar
involucradas en la enfermedad, motivo por el cual actualmente
se tiende a llamarla ornitosis. Esta enfermedad varía
en gravedad desde casos muy leves hasta cuadros de gran intensidad.
Su letalidad es cercana al 10%. El cuadro clínico es
inespecífico, suele haber compromiso de otros órganos
como hepatoesplenomegalia, adenopatías, eritema nodoso,
etcétera. El diagnóstico se puede establecer por
serología y se recomienda tratarla con macrólidos,
tetraciclinas o fluoroquinolonas.
La Chlamydia pneumoniae, también
conocida por la sigla TWAR (Taiwan acute respiratory agent),
correspondiente a la primera cepa identificada, fue identificada
recientemente y se transmite entre seres humanos. Se manifiesta
por un cuadro clínico-radiográfico similar a la
neumonía por micoplasma y también afecta de preferencia
a individuos jóvenes, en los que causa hasta un 10% de
las neumonías adquiridas en la comunidad, que se caracterizan
porque generalmente son de leve intensidad y presentan faringitis
importante concomitante o previa al compromiso pulmonar. También
puede producir infección asintomática y cuadros
de compromiso aislado de la vía aérea superior,
especialmente faringitis.
Su cultivo exige líneas celulares y
la recuperación de la bacteria es extremadamente baja
por lo que no está disponible en los laboratorios de
microbiología clínica. Su diagnóstico se
realiza por serología o técnicas de amplificación
de ácidos nucleicos en muestras respiratorias, y se recomienda
tratar con macrólidos, tetraciclinas o fluoroquinolonas.
NEUMONIA POR LEGIONELLA
PATOGENIA
La Legionella pneumophila es un bacilo
gramnegativo que vive en el ambiente, en el agua tibia de lagos,
agua potable y sistemas de aire acondicionado. La enfermedad
se adquiere al inhalar aerosoles originados en fuentes contaminadas.
Al parecer, la transmisión de persona a persona no es
importante. Si bien la infección es a menudo asintomática,
la mayoría de los enfermos con síntomas desarrolla
neumonía, la que se observa con mayor frecuencia en varones
mayores de 50 años, fumadores y en pacientes con diabetes,
EPOC, uso de esteroides, hemodiálisis, trasplantes o
enfermedades con inmunodepresión celular. . La neumonía
por Legionella se reconoció por primera vez en
una epidemia ocurrida en 1977 en un hotel de Filadelfia durante
una convención de la Legión Americana, pero estudios
retrospectivos demuestran que brotes similares habían
ocurrido previamente. La legionellosis puede ocurrir como neumonías
esporádicas o como brotes epidémicos, por lo que
su frecuencia en diferentes estudios varía ampliamente
entre cero y 25%. En Chile se han registrado casos aislados
y se ha demostrado una seroprevalencia similar a la de países
desarrollados. Los estudios microbiológicos realizados
en el medio nacional han demostrado una baja prevalencia en
adultos hospitalizados con neumonía adquirida en la comunidad.
La neumonía por Legionella se incluye dentro de
las neumonías comunitarias de presentación grave,
junto a Streptococcus pneumoniae y algunos bacilos gramnegativos.
CUADRO CLINICO
El cuadro clínico no es característico:
su comienzo es gradual con tos seca, que posteriormente se hace
productiva y, en un tercio de los casos, hemoptoica. No se observan
síntomas de la vía aérea superior. Existe
fiebre elevada permanente y dolor pleural en un tercio de los
casos. El compromiso extrapulmonar es más frecuente que
en otras neumonías, con vómitos, diarrea y manifestaciones
neurológicas.
La radiografía de tórax muestra
una condensación homogénea lobular, que tiende
a progresar y comprometer múltiples lóbulos y
a hacerse bilateral, aun con tratamiento apropiado. La excavación
es poco frecuente, excepto en inmunodeprimidos. El hemograma
muestra leucocitosis mayor de 15.000/mm3 sólo
en una baja proporción de los casos, y linfopenia en
forma relativamente frecuente. Se observa hiponatremia en una
proporción importante de los pacientes y suele haber
alteraciones de laboratorio compatibles con compromiso hepático
y renal.
La sospecha de neumonía por Legionella
surge en un contexto epidemiológico adecuado y por
la presencia de los datos clínicos y biológicos
señalados, entre ellos la gravedad del proceso. Un hábito
tabáquico importante, la ausencia de respuesta a los
antibióticos betalactámicos
y la observación de escasos microorganismos en un esputo
lleno de neutrófilos son características que apoyan
el diagnóstico. El diagnóstico por tinción
es poco sensible. El cultivo de muestras de expectoración
es complejo, ya que la flora normal inhibe su desarrollo. La
inmunofluorescencia directa de muestras respiratorias (sensibilidad:
25-70% y especificidad: 95%), el antígeno urinario de
L. pneumophila serogrupo 1 (sensibilidad: 60-90%
y especificidad: 99%) y los cambios serológicos (sensibilidad:
40-60% y especificidad: 96-99%) son los métodos más
utilizados para establecer el diagnóstico.
La legionellosis es una enfermedad grave, ya
que si no se efectúa un tratamiento específico
un tercio de los pacientes evoluciona hacia insuficiencia respiratoria
grave y 20% fallece. El tratamiento de la neumonía por
Legionella está condicionado por la naturaleza
intracelular de este patógeno. Así, sólo
resultan efectivos los antibióticos que se concentran
de forma significativa en los macrófagos (macrólidos,
quinolonas, rifampicina, cotrimoxazol y tetraciclinas). El tratamiento
con eritromicina (2 g oral en casos leves y 4 g endovenoso en
casos graves), a la que se le suele asociar rifampicina, disminuye
la letalidad al 5%. La neumonía por Legionella mejora
lentamente, por lo que requiere tratamientos prolongados y suele
dejar secuelas.
| Debe pensarse
en legionela ante neumonías graves en brotes epidémicos
o en individuos con defensas alteradas |
NEUMONÍA POR MORAXELLA CATARRHALIS
Moraxella catarrhalis es un diplococo
gramnegativo, aerobio, que coloniza las vías aéreas
superiores de la mayoría de los individuos normales.
Desde su descubrimiento, a fines del siglo XIX, ha sido objeto
tanto de cambios en su nombre, su clasificación taxonómica
y su calificación como comensal o patógeno.
Actualmente, es aceptado como el tercer patógeno más
importante en el tracto respiratorio humano después
de Streptococcus pneumoniae y Haemophilus influenzae.
Moraxella catarrhalis ha sido descrita
exclusivamente en humanos, siendo capaz de colonizarlos sin
causar enfermedad, motivo por el cual esta bacteria se clasificó
inicialmente como comensal. El foco primario de colonización
es el tracto respiratorio humano y el riesgo de colonización
es variable y depende de diferentes factores como la edad,
estado de salud, factores socioeconómicos, localización
geográfica y variación estacional.
Este microrganismo ocasiona infecciones del
tracto respiratorio inferior en tres situaciones :
a) exacerbaciones en pacientes con EPOC.
b) neumonía en ancianos.
c) infecciones nosocomiales.
Se estima que, aproximadamente, un 10% de
las neumonías adquiridas en la comunidad en los ancianos
son causadas por M. catarrhalis. El cuadro clínico
incluye fiebre, tos, expectoración purulenta, signos
en la auscultación e infiltrados lobulares o intersticiales
en la radiografía. La mayoría de estos ancianos
tienen como factor predisponente una enfermedad cardiopulmonar
subyacente, como EPOC, bronquiectasias, insuficiencia cardíaca
congestiva, predisposición a aspiración, tratamiento
con corticoides, diabetes mellitus o cáncer.
El diagnóstico puede sospecharse por
la presencia de numerosos diplococos gramnegativos en la expectoración
y confirmarse por cultivo de un elevado número de estos
gérmenes. Las nuevas tecnologías basadas en
el DNA han abierto nuevos caminos para la detección
de M. catarrhalis en muestras clínicas, sin
la necesidad del cultivo bacteriológico. Aproximadamente,
el 90% de las cepas son productoras de betalactamasas.
Así, una alta proporción de ellos son resistentes
a ampicilina pero sensibles a sulbactam-ampicilina, amoxicilina-ácido
clavulánico, tetraciclina y macrólidos.
Vínculos Extraprogramáticos
-
Actualización 2007
de indicación de antibióticos en neumonía
adquirida en la comunidad
Tabla en "Infectious Diseases Society of America/American
Thoracic Society Consensus Guidelines on the Management
of Community-Acquired Pneumonia in Adults Clin Infect Dis
2007; 44: S27-72.
http://www.journals.uchicago.edu/doi/pdf/10.1086/511159
|
|
|
