|
|
|
Introducción
La tuberculosis, por ser uno de los mas graves
problema de salud mundial, es abordada en parte importante del mundo,incluido
nuestro país, en forma diferente a las demás enfermedades
respiratorias. Su enfrentamiento está regidos por normas
oficiales cuya aplicación corresponde en la parte diagnóstica
básicamente a clÍnicos en el nivel primario y en el
tratamiento, a un programa nacional. Los contenidos de este capítulo
son esenciales para comprender el por qué
de las normas y así asegurar su fiel aplicación.
HISTORIA
|
| |
El bacilo de Koch (BK)
y el hombre han convivido durante miles de años, como lo
prueba el descubrimiento de lesiones tuberculosas en osamentas
muy antiguas. Entre ambas especies existe un especial modo de
coexistencia, la cual en la mayor parte de los casos no significa
enfermedad humana y sí destrucción de la mayoría
de los bacilos. La supervivencia del bacilo depende de que algunos
hombres enfermen y diseminen gérmenes al ambiente, lo que
permite que algunos bacilos encuentren un nuevo huésped
susceptible y así perpetúar su especie. Esto explica
que el objetivo base de la lucha antituberculosa sea cortar la
cadena del contagio.
La enfermedad tuberculosa
(TBC) es altamente letal, ya que aproximadamente la mitad de los
sujetos que enferman mueren en el lapso de dos años si
no se efectúa un tratamiento adecuado. El contagio no es
fácil, puesto que en estos dos años sólo
se produce contagio e infección de diez casos nuevos por
cada enfermo. Si se considera que aproximadamente el 10% de los
infectados enferma, se comprende que en su estado natural la enfermedad
tienda a mantenerse estacionaria dentro de una comunidad, ya que
los nuevos enfermos reemplazan como fuentes de contagio a los
fallecidos.
En el pasado existía
una tasa elevada de infección tuberculosa y un alto porcentaje
de la población enfermaba y moría de "tisis", mal
que constituía un azote tan temido como ocurre en la actualidad
con las enfermedades cardiovasculares, el cáncer o el SIDA.
Estas condiciones aún persisten en algunos países
en vías de desarrollo.
La situación epidemiológica
comenzó a cambiar en los países desarrollados en
el siglo XIX, debido a la mejoría en las condiciones de
vida de la población, especialmente de la vivienda. Esto
se debe a que el bacilo de Koch tiene gran susceptibilidad al
efecto de la luz, que lo destruye en pocos minutos, Las habitaciones
con mayor número de ventanas y la disminución del
hacinamiento llevaron a una progresiva reducción de la
probabilidad de contagio, por lo que la morbimortalidad asociada
a la infección tuberculosa comenzó a decrecer muchos
años antes de la aparición de drogas antituberculosas
eficaces. El advenimiento de éstas a mitad del siglo XX
ha acelerado la caída de las tasas de infección
y, especialmente, de la mortalidad, pues la letalidad en los enfermos
ha disminuido considerablemente. Sin embargo hay muchos países
en los cuales la situación sigue siendo grave por lo cual
se calcula que existen alrededor de 20.000.00 de enfermos con
unos 2 millones de muertes anuales.
La gran incidencia y gravedad
de la TBC, la posibilidad de detectar precozmente a los sujetos
contagiantes para tratarlos, así como la de prevenir algunas
formas de la enfermedad mediante la vacunación, han llevado
a la mayor parte de las comunidades a considerar la TBC como un
problema de salud pública y a desarrollar programas de
lucha antituberculosa que han permitido una progresiva disminución
del problema. La lucha contra la TBC se ha coordinado a escala
mundial a través la Unión Internacional contra la
Tuberculosis , organización que ha prestado servicios de
investigación, difusión y evaluación de los
programas. Por ello, el tratamiento de la TBC en la mayoría
de los países se ha logrado estandarizar, con el propósito
de lograr la máxima eficiencia y evitar la aparición
de resistencia a los antimicrobianos. En Chile existe desde 1973
un Programa de Control de la TBC (PCT) que, en continuo perfeccionamiento,
rige el manejo de esta enfermedad.
El problema de la TBC traspasa
las fronteras de los países, ya que el movimiento de personas
lleva el contagio desde los países con menor control a
los más desarrollados en este sentido. En Chile, este problema
se está viviendo en las ciudades de la I y la II Regiones,
en las cuales las tasas de TBC son mayores que en el resto del
país, debido al tránsito de personas provenientes
de países con mayores tasas de enfermedad.
Durante los últimos
años, diferentes países del mundo, tanto subdesarrollados
como desarrollados,han presentado un quiebre de la tendencia decreciente
del problema TBC, lo que se debería, por una parte, a la
aparición del SIDA, que proporciona una masa de individuos
inmunodeprimidos más susceptibles de enfermar y contagiar.
Por otra parte, en diferentes países se ha producido algún
grado de relajación en la intensidad de los programas antituberculosos
por pensarse erróneamente que con la quimioterapia el problema
estaba resuelto. Un serio agravante del problema es que el uso
inadecuado de las drogas ha llevado aun aumento alarmante de cepas
resistentes a los medicamentos existentes.
Aunque la situación
en Chile ha mejorado considerablemente respecto al pasado, la
tuberculosis pulmonar aún es una importante causa de morbilidad
y mortalidad. Cada día se diagnostican aproximadamente
7 casos nuevos y muere un paciente.
Debido a sus especiales
características, el manejo de los pacientes tuberculosos
debe considerar aspectos sociales y culturales que influyen en
mayor medida que en otras enfermedades. Por este motivo se explicarán,
cuando sea apropiado, algunas razones históricas y sociales
que justifican las conductas terapéuticas actuales.
EPIDEMIOLOGIA
El dato mejor conocido
es la mortalidad, registrada en nuestro país desde comienzos
del siglo XX (Figura 31-1).
Figura 31-1.
Evolución de la mortalidad en Chile.
En la primera mitad del
siglo XX, la mortalidad osciló entre 220 y 250 por 100.000
habitantes, representando alrededor de un 10% de las muertes.
En la década de 1950 se produjo una caída espectacular
a una cuarta parte debido a la introducción de la quimioterapia.
También contribuyó la extensión de la vacunación
BCG, que explicaría el mayor descenso de la mortalidad
en los niños, con marcada reducción de los casos
de meningitis TBC. En la década de 1960 la mortalidad
siguió disminuyendo, pero con un ritmo mucho menor, lo
que correspondería al período en que los esquemas
de tratamiento y detección estaban en plena etapa de
ensayo y corrección. En los últimos años
la mortalidad cayó hasta cifras inferiores a 2 por 100.000,
lo que se puede atribuir al perfeccionamiento del PCT, con mejor
detección y extensión del tratamiento controlado.
También podría pesar la introducción de
la rifampicina bajo la forma de tratamientos abreviados.
Sobre morbilidad sólo
hay datos desde 1971. Ha disminuido más lentamente que
la mortalidad, debido a que el tratamiento es eficaz para impedir
la muerte, pero influye menos en la transmisión de la
enfermedad ya que el contagio se mantiene por los enfermos que
no se tratan o lo abandonan antes de de haberse controlado la
eliminación de bacilos al ambiente. La morbilidad se
mantuvo más o menos estable hasta 1977, con cifras que
oscilaron entre 81 y 91 por 100.000. Luego se ha observado una
caída progresiva hasta 14,7 por 100.000 en 2008, la más
baja históricamente registrada en Chile. La tasa de morbilidad
de la tuberculosis pulmonar con baciloscopía directa
positiva descendió, a 6 por 100.000 en el 2005. Esto
coincide con la introducción de los tratamientos acortados
que sanan rápidamente a los enfermos bacilíferos,
disminuyen el abandono de tratamiento y, por consiguiente, reducen
las fuentes de contagio. La caída de la morbilidad y
mortalidad ha sido mucho más acentuada en los menores
de 15 años, probablemente debido a la vacunación
BCG y a la disminución de las fuentes de contagio. En
los sujetos de mayor edad estos factores han influido menos,
debido a que la enfermedad se produce generalmente por reactivación
de la primoinfección contraída en la juventud.
Durante los últimos
años se ha observado una disminución de la velocidad
de descenso en la morbilidad y mortalidad por TBC en Chile.
Incluso, en algunas regiones se está observando un preocupante
ascenso en las cifras, que ha sido atribuido en gran medida
a oscilaciones en los recursos asignados al Programa con fallas
en el diagnóstico y tratamiento de los pacientes. Las
cifras epidemiológicas son bastante heterogéneas
a lo largo del país como lo demuestran las siguientes
cifras de un estudio del 2008 que exponen las tasas y el porcentaje
de la población que la exhiben:
Tasas
% de la población
| <10/100.000
|
32,88
|
| 10-14/100.000 |
41,7 |
| 15-19/100.000 |
16,1 |
| >20/100.000 |
9,4 |
El área Oriente
de Santiago está en el primer grupo y Arica, Iquique
y Magallanes en el último
La evolución de
las características epidemiológicas de la morbilidad
por tuberculosis corresponde a una tendencia declinante con
desplazamiento de la incidencia hacia los grupos etarios de
mayor edad y predominio creciente del sexo masculino. La proporción
de formas clínicas extrapulmonares, en el total de casos
registrados anualmente, es otra característica que se
relaciona con el nivel de la endemia: a medida que disminuye
la tasa total aumenta la proporción de casos extrapulmonares.
En Chile, esta participación alcanza al 24,8%, muy similar
a la observada en años recientes en países europeos
con tasas de morbilidad inferiores a 20 por 100.000
Hasta mediados de la
década de los sesenta, el diagnóstico de la tuberculosis
en Chile se sustentaba en la radiología, complementada
con la bacteriología en aquellos casos en que se evidenciaban
lesiones radiológicas compatibles o sospechosas de la
enfermedad. Posteriormente se decidió priorizar la identificación
y tratamiento de las fuentes de contagio, vale decir, de los
enfermos de tuberculosis pulmonar con baciloscopía positiva.
Para tal efecto se hizo indispensable ampliar la base diagnóstica,
o sea, los laboratorios en capacidad de realizar técnicas
bacteriológicas para la investigación de tuberculosis.
Lograda esta ampliación se procedió a articular
y organizar esta infraestructura en una red funcional de laboratorios,
con los adecuados niveles de complejidad técnica. Esta
organización se logró en plenitud ya a comienzos
de la década de los setenta, incorporando , como una
de sus actividades prioritarias, un programa permanente de control
de calidad de la baciloscopía. La organización
de los laboratorios ha permitido absorber la demanda de baciloscopías
para localización de casos y diagnóstico, que
ha oscilado entre 320.000 y 380.000 anuales, realizando además
180.000 a 190.000 cultivos, según indicaciones selectivas
normadas, y un número variable de 2.000 a 3.000 exámenes
de referencia, entre pruebas de sensibilidad e identificación
de micobacterias, centralizadas éstas en el laboratorio
de referencia nacional.
Como síntesis
de la situación epidemiológica descrita, se puede
aseverar que en Chile la endemia ha evolucionado favorablemente,
con una tendencia declinante de la morbilidad. El promedio nacional
alcanzó el nivel de incidencia considerado como “"umbral
de la etapa de eliminación"” (20 por 100.000
habitantes) en el año 2000 y podría llegar a la
zona que caracteriza la etapa de “"eliminación
avanzada"” hacia el 2010 (10 por 100.000). Sin embargo
, existe preocupación al respecto porque la incidencia
que venia cayendo en un 7% ha disminuido su velocidad a un 4,9
%. Factores en este frenamiento han sido , entre otros, la emergencia
de resistencias múltiples a antibióticos, la asociación
al SIDA y algunas fallas en el diagnóstico oportuno ligadas
a la falsa y peligrosa sensación que la TBC ha sido derrotada.
PATOGENIA
EL BACILO DE KOCH
Desde el punto de vista
biológico, clínico y epidemiológico, el
bacilo de Koch (BK) tiene las siguientes características
importantes:
a) Las especies que
producen enfermedad en el hombre son, fundamentalmente, la
variedad humana y la bovina. Otros tipos de micobacterias,
a veces llamadas “"atípicas", enferman
al hombre con muy baja frecuencia, produciendo entidades clínicas
similares a la TBC. Su importancia relativa va creciendo a
medida que la tuberculosis disminuye su incidencia y aumentan
la epidemia de SIDA y las condiciones que ocasionan inmunodepresión
(enfermedades anergizantes, tratamientos antineoplásicos,
trasplantes, etc.). Estas micobacterias atípicas causan
frecuentemente adenitis TBC en niños y son generalmente
difíciles de tratar, ya que estos gérmenes son
naturalmente multirresistentes a los antibióticos disponibles.
b) Por la especial
estructura de su pared, el BK es altamente resistente a las
condiciones físicas y químicas adversas, lo
que le permite sobrevivir largo tiempo en el ambiente. Sin
embargo, fuera del hombre no es capaz de multiplicarse.
c) Tiene la característica
tintorial de resistir la decoloración con alcohol y
ácido, lo que permite distinguirlo con facilidad de
otros gérmenes. Por ello, el principal recurso diagnóstico
en la tuberculosis pulmonar es la observación de un
extendido de expectoración teñido con el método
de Ziehl-Nielsen. En otros países, en que existe mayor
cantidad de otras especies de micobacterias, la baciloscopía
debe corroborarse con la identificación por cultivo.
En Chile este problema prácticamente no existe, por
lo que la baciloscopía positiva de expectoración
se considera diagnóstica de TBC pulmonar. Esto no es
válido para otras muestras, como la orina por ejemplo,
en la que frecuentemente se encuentran otros bacilos alcohol-ácido
resistentes no tuberculosos.
d) El BK se desarrolla
con dificultad en los medios de cultivo de laboratorio, necesitando
entre 30 y 60 días para generar colonias. Sus características
de coloración y reacciones bioquímicas permiten
reconocer las diferentes especies de micobacterias. Se han
desarrollado métodos de cultivo acelerado que permiten
detectar con relativa rapidez la presencia de BK, pero aún
no son de uso masivo en clínica en nuestro país.
e) El BK es altamente
resistente a los mecanismos inespecíficos de defensa
del pulmón. Cuando los macrófagos alveolares
no activados lo fagocitan, puede seguir multiplicándose
sin dificultad en su interior. En cambio, los mecanismos específicos
de defensa, en particular los celulares mediados por linfocitos
T, son un medio eficaz para eliminar la mayor parte de los
BK.
f) A diferencia
de la respuesta celular, la humoral parece ser desfavorable
para el huésped, lo que se debería a que los anticuerpos
anti-BK no sólo son incapaces de destruir al germen,
sino que al recubrir su superficie dificultarían su reconocimiento
por los linfocitos T, lo que entorpecería los mecanismos
defensivos celulares.
COMPLEJO PRIMARIO O
PRIMOINFECCION TUBERCULOSA
Cuando un enfermo con
tuberculosis pulmonar tose, elimina gérmenes al ambiente.
Una parte de ellos se encuentran en la expectoración,
donde pueden ser reconocidos mediante la baciloscopía
estableciendo el diagnóstico definitivo, y otros salen
en pequeñas gotas de líquido, de 2 o 3 micrones
de diámetro, que pueden quedar flotando en el ambiente,
ser inhaladas y llegar a depositarse en los alvéolos.
Si el nuevo huésped
no ha tenido contacto previo con el BK, éste se multiplica
libremente en el intersticio pulmonar o dentro de los macrófagos
alveolares que llegan al sitio donde se está produciendo
este fenómeno. En este momento se pueden producir dos
tipos de evolución (Figura 31-2). Lo más frecuente
es que los individuos sean capaces de montar una respuesta inmune
eficaz en un plazo breve, cuando el número de BK es aún
pequeño, lo que determina su destrucción. La evolución
menos frecuente es que, por la gran magnitud del inóculo
inicial, por la presencia de condiciones anergizantes tales
como desnutrición, inmunosupresión y alcoholismo,
o por razones genéticas, se implemente una respuesta
inmune demasiado lenta, con lo cual la cantidad de BK llega
a ser excesiva, lo que determina que la respuesta inmune posterior
tienda a destruir los tejidos, lo que favorece la multiplicación
del microorganismo y la mantención de la enfermedad.

Figura
31-2. Representación esquemática de la
evolución natural de la tuberculosis. La primoinfección,
generalmente pulmonar, produce un complejo primario que, en
la mayoría de los casos cura, persistiendo bacilos en
inactividad metabólica (durmientes). Con menor frecuencia
el complejo evoluciona hacia una tuberculosis pulmonar extensa
(progresión primaria). La tuberculosis por reactivación
endógena ocurre cuando los bacilos durmientes pueden
multiplicarse por fallas inmunitarias. En cualquiera de estas
circunstancias suele haber diseminación hematógena,
que evoluciona eventualmente a una TBC miliar o hacia una siembra
extrapulmonar, que puede ser fuente de tuberculosis en diferentes
órganos.
Es importante mencionar
que la reacción inmune frente al BK tiene dos connotaciones:
por una parte es importante para evitar la progresión
de la enfermedad, pero también explica la producción
de lesiones en los tejidos a través de un fenómeno
que puede calificarse como hipersensibilidad.
En los pacientes con
respuesta inmune eficaz, algunos gérmenes intracelulares
pueden permanecer vivos pero metabólicamente inactivos,
manteniéndose en este estado en la medida que el aparato
defensivo pulmonar sea eficaz. Estos gérmenes "dormidos"
o persistentes son fuente eventual de enfermedad si los mecanismos
defensivos fallan en su misión de mantenerlos inactivos,
hecho que ocurre en casos de desnutrición, diabetes,
enfermedades anergizantes, tratamiento con inmunodepresores,
silicosis, etc.
Durante el período
de multiplicación previo al montaje de la respuesta inmune,
los bacilos suelen invadir el torrente sanguíneo, produciéndose
diseminaciones al resto del pulmón y a otros órganos,
lo que ocasiona episodios de tuberculosis extrapulmonar incluso
años después (Figura 31-2). También es
muy frecuente el compromiso ganglionar regional, lo que causa
la imagen radiográfica típica del complejo primario
o de Ranke, formada por un foco de condensación pulmonar
(foco de Gohn) y una adenopatía hiliar aumentada de tamaño,
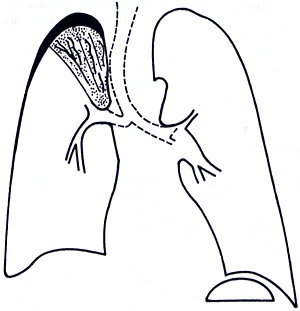
con un aspecto de "palanqueta" (Figura 31-3).

Figura
31-3. Complejo primario. Se observa una pequeña
condensación en el pulmón derecho con una
adenopatía hiliar-
En el sitio de la inflamación
se forma un granuloma, que puede tener su centro caseificado.
Cuando la lesión cura, se produce un foco de fibrosis,
que se calcifica en muchos casos, siendo reconocible en las
radiografías de tórax.
La primoinfección
TBC se desarrolla con mayor frecuencia en los niños y
adolescentes no vacunados. En la mayor parte de ellos es asintomática
o produce síntomas inespecíficos, por lo que suele
pasar inadvertida como una infección banal. Los grupos
más expuestos para adquirir la primoinfección
son los individuos de nivel económico-social bajo y el
personal de salud, más expuesto al contagio.
Ocasionalmente la lesión
ganglionar comprime la vía aérea produciendo obstrucción
bronquial, hiperinsuflación pulmonar localizada seguida
de atelectasia. Al curar, la adenopatía deja de obstruir
y el pulmón se expande. En algunos casos la atelectasia
persiste o quedan bronquiectasias como secuela.
La primoinfección
tuberculosa extrapulmonar es actualmente rara. En el pasado
la infección intestinal por el BK bovino era relativamente
frecuente, por contaminación de la leche con BK provenientes
de mastitis bovina. El control de esta enfermedad en el ganado
y, especialmente, la pasteurización de la leche casi
han hecho desaparecer esta forma de primoinfección.
TUBERCULOSIS PULMONAR
PRIMARIA PROGRESIVA
Este tipo de enfermedad
es poco frecuente y se observa preferentemente en niños.
Se produciría en los casos en que existe una demora
en el montaje de la respuesta defensiva celular durante una
primoinfección. En estas circunstancias los bacilos
sobrepasan el número crítico, por lo que se
observa progresión de la lesión primaria con
formación de cavidades y lesiones destructivas en el
pulmón.
REACTIVACION TUBERCULOSA
Como resultado de la
primoinfección tuberculosa queda la sensibilización
contra el bacilo de Koch, que mantiene a los gérmenes
persistentes en inactividad metabólica y actúa
contra una nueva infección tuberculosa exógena.
Esta última rara vez produce enfermedad, debido a que
la llegada de nuevos BK a un alvéolo provoca una reacción
que, en el individuo sensibilizado, demora sólo dos
o tres días y como los BK son aun escasos, son destruidos
fácilmente.
En los pacientes cuyos
mecanismos defensivos celulares están deprimidos por
edad, desnutrición, alcoholismo, diabetes, insuficiencia
renal, enfermedades anergizantes o uso de inmunodepresores,
la vigilancia inmunológica sobre los bacilos persistentes
falla y éstos comienzan a multiplicarse activamente,
por lo que en 12-14 días alcanzan el número
crítico para producir una enfermedad cavitaria. Algunas
de las condiciones mencionadas están frecuentemente
asociadas con la pobreza, lo que explica que la tuberculosis
afecte más a los grupos socioeconómicos bajos.
El mecanismo descrito
ha sido denominado "reinfección endógena", a
diferencia de la "reinfección exógena", que
supone la llegada de nuevos bacilos desde una fuente de contagio
externa. La reinfección endógena explica, en
la mayoría de los casos, la tuberculosis pulmonar postprimaria
de los adultos . Los focos que con mayor frecuencia se reactivan
son los de los lóbulos superiores, lo cual ha sido
atribuido a la menor perfusión y mayor presión
parcial de oxígeno alveolar de ese territorio en la
posición erecta, asociado al menor drenaje linfático
de la zona. .Recientemente se ha demostrado, mediante estudios
que identifican cepas con técnicas de ingeniería
genética, que la reinfección exógena
es posible.
VACUNACION BCG
Consiste en la inoculación
de un bacilo de Koch atenuado, no patógeno (bacilo
de Calmette y Guerin, BCG), a los individuos susceptibles.
Esta infección artificial es capaz de simular la primoinfección
natural sin los riesgos de progresión primaria o de
persistencia de BK patógenos. En Chile, la vacuna BCG
se administra a los recién nacidos con peso igual o
mayor a 2000 gramos al egresar de la maternidad, a los menores
de un año no vacunados al nacer y a los contactos de
tuberculosos bacilíferos, menores de 5 años,
no vacunados con BCG, al término de un período
de quimioprofilaxis. La vacunación BCG es obligatoria
en el recién nacido y en los últimos 15 años
las coberturas han sido constantemente superiores al 95%,
y con frecuencia superiores al 98%. Hasta el año
2004 se realizaba revacunación a los escolares en primer
año básico (6 a 8 años de edad), lo que
se suspendió por los cambios epidemiológicos
ocurridos con la endemia de la TBC en nuestro país.
Como resultado de este procedimiento se logra montar, en aproximadamente
un 70% de los casos, una respuesta celular inmune capaz de
evitar la infección pulmonar por BK patógenos.
Si esta última eventualmente se produce, la probabilidad
de diseminación disminuye acentuadamente, por lo cual
la frecuencia de la grave meningitis tuberculosa infantil
casi ha desaparecido. Considerando la situación epidemiológica
actual de la tuberculosis en Chile y el valor protector del
BCG, fundamentalmente en niños de baja edad y en relación
con formas graves de diseminación de la primoinfección,
la vacunación BCG forma parte de las medidas de intervención
del Programa de Control de la Tuberculosis.
REACCION TUBERCULINICA
O PPD
La existencia de una
respuesta inmune celular antituberculosa, resultado de la
primoinfección o de la vacunación con BCG, puede
reconocerse mediante una intradermorreacción. En ella
se utiliza el "derivado proteico purificado" o PPD, antiguamente
llamado "tuberculina", que se inyecta en la cara ventral del
tercio medio del antebrazo izquierdo. Una reacción
positiva se observa a las 72 horas como una induración
mayor de 5 mm en niños y 8 mm en los adultos.
La prueba de tuberculina
(PPD) permite medir la alergia producida por la infección
tuberculosa. La reacción tuberculínica diferencia
entre reactores y no reactores. Los reactores representan
personas que han sido infectadas por el bacilo de Koch. Aplicada
a una población, separa infectados de no infectados
y así permite establecer la prevalencia de la infección
tuberculosa en esa población.
El empleo de la reacción
tuberculínica con fines clínicos o epidemiológicos
exige la máxima exactitud y estandarización
a fin de obtener resultados confiables, reproducibles y comparables.
Esto ha obligado a establecer la prueba tuberculínica
estándar, entendiéndose como tal el procedimiento
cuantitativo que consiste en la medición cuidadosa
de las reacciones de la piel a la inyección intradérmica
de una dosis uniforme de tuberculina.
Las principales indicaciones
de la reacción tuberculínica son: a) los estudios
epidemiológicos de población, b) la prueba de
aproximación diagnóstica c) la identificación
de pacientes de alto riesgo de hacer tuberculosis, y d) la
evaluación de la respuesta a la vacuna BCG.
Una reacción
de PPD positiva en nuestro nivel epidemiológico sólo
significa que el individuo ha sido infectado, o vacunado pudiendo
o no estar enfermo, razón por la que en el adulto este
examen no sirve como método diagnóstico. Esto
es especialmente válido si se considera que una reacción
de PPD negativa no excluye la existencia de una enfermedad
tuberculosa activa, pues el individuo que enferma de TBC lo
hace por un déficit inmunitario transitorio o definitivo.
Es así como entre un 20 y un 30% de los pacientes con
TBC pulmonar activa, recién diagnosticada, tienen PPD
negativo. La reacción de PPD negativa en presencia
de TBC activa es más frecuente en las formas más
graves, como la diseminación "miliar", precisamente
porque esta diseminación es consecuencia de un déficit
inmunitario. No obstante, en los casos en que se comprueba
la existencia de una reactividad inmunitaria celular normal,
un PPD negativo es altamente sugerente de ausencia de infección
TBC.
En estudios de contactos
de enfermos tuberculosos, especialmente en niños, ocasionalmente
se puede pesquisar el cambio de PPD negativo a positivo, fenómeno
denominado "viraje tuberculínico". En estos casos la
reacción de PPD adquiere un significado diagnóstico,
pues implica que se ha producido recientemente la primoinfección,
con el consiguiente mayor riesgo de progresión primaria.
Se habla de conversión o viraje tuberculínico
cuando una segunda reacción al PPD aumenta de menos
de 10 mm a más de 10 mm de induración, con una
diferencia de más de 6 mm entre las dos reacciones.
Cuando este viraje ocurre dentro de un plazo de dos años
se estima que representa una infección reciente con
el M. tuberculosis.
En la interpretación
de la prueba a nivel individual, así como en la evaluación
del riesgo de infección en el estudio de grupos, específicos
se recomienda utilizar los siguientes criterios: a) 0-4 mm,
no reactor: no están infectados y son falsos negativos.
b) 5-9 mm, reactores débiles: están infectados
por Mycobacterium tuberculosis, son reacciones cruzadas
o están vacunados por BCG. c) 10 a 14 mm, reactores
francos: están infectados, son pacientes tuberculosos,
vacunados con BCG o reacciones cruzadas. d) Mayor de 15 mm,
reactores intensos: están infectados o son enfermos
TBC.
Las principales causas
de reacciones falsas negativas (hiporreactividad a la tuberculina)
que limitan la sensibilidad de la prueba son las siguientes:
a) Factores del huésped:
infección por VIH, otras enfermedades inmunosupresoras
(linfoma de Hodgkin) y tratamientos inmunodepresores, vacunación
con virus vivos (polio, sarampión), infecciones virales
(sarampión, varicela, parotiditis), desnutrición,
TBC aguda o diseminada, embarazo y uso de contraceptivos;
b) Errores técnicos:
almacenamiento inadecuado del PPD, errores de dilución
del PPD, inyección subcutánea, uso de PPD vencido
y falta de experiencia en lectura e interpretación.
Recientemente se han
introducido métodos que captan la liberación
de interferón por parte de linocitos sanguíneos
sensibilizados al ponerlos en contacto con antígenos
del bacilo de Koch más específicos que el PPD,
pero que aún un han sido incorporados al Programa.
CARACTERISTICAS CLINICAS
HISTORIA Y EXAMEN FISICO
Durante largos años
se acumuló experiencia sobre las múltiples manifestaciones
de esta enfermedad, ya que la falta de un tratamiento específico
eficaz hacía que el médico tuviera que asistir
a toda su evolución, desde el comienzo de los síntomas
hasta la muerte en etapas avanzadas. Actualmente, los casos
avanzados con sintomatología florida son cada vez más
raros. Esto, junto con la existencia de un tratamiento eficaz
y de una red de laboratorios bacteriológicos fidedignos,
ha centrado el énfasis en la pesquisa precoz en etapas
asintomáticas o con molestias inespecíficas.
Existen pacientes con
alto riesgo de desarrollar tuberculosis pulmonar por alteración
de su función inmunitaria. Entre éstos destacan
los enfermos con diabetes, insuficiencia renal, alcoholismo
y silicosis, desnutrición, así como aquellos que
reciben corticosteroides en dosis altas. Igualmente influye
la edad y actualmente la incidencia aumenta progresivamente
desde la infancia para llegar al máximo sobre los 60
años, especialmente en hombres,
Los síntomas y
signos son inespecíficos e inconstantes y, si bien pueden
llegar a ser extremadamente sugerentes, en ningún caso
permiten obviar el estudio bacteriológico y radiográfico
para decidir el tratamiento específico y para conocer
la magnitud de la enfermedad, respectivamente.
Si se plantea el diagnóstico
de TBC pulmonar, se debe proceder al estudio bacteriológico,
con la complementación radiográfica que el caso
individual necesite, sin que en esta conducta pesen los detalles
del cuadro clínico. Incluso, en muchos casos el solo
contacto con un enfermo bacilífero justifica el estudio.
Teniendo presente lo
anterior se analizarán los principales elementos clínicos
que presentan los pacientes con TBC pulmonar.
a) Estado asintomático:
es la regla en lesiones incipientes y aún medianas. El
complejo primario rara vez causa síntomas y éstos
pueden confundirse con una infección respiratoria banal.
En la TBC del adulto, un número importante de casos se
pesquisa en exámenes de salud y en el estudio de contactos
de enfermos.
b) Tos con expectoración:
es la manifestación más frecuente de la enfermedad.
A pesar de su falta de especificidad, se ha constituido en una
importante herramienta de detección en el Sistema Nacional
de Servicios de Salud, que tiene la norma de efectuar baciloscopías
a todo sintomático respiratorio, definido como
aquel consultante que presenta tos y expectoración (o
hemoptisis) por más de 2 semanas, cualquiera sea el motivo
de consulta. La expectoración puede ser mucosa o mucopurulenta;
la presencia de sangre es sugerente de TBC y obliga a un diagnóstico
diferencial activo y metódico.
c) Hemoptisis:
la TBC es causa frecuente de hemoptisis pequeñas y medianas.
Ocasionalmente se observan hemoptisis masivas, que se deben
a aneurismas que se forman dentro de las cavidades (aneurismas
de Rasmussen) debido a que la enfermedad afecta la pared arterial.
d) Compromiso del
estado general: corresponde, generalmente, a cuadros avanzados
con lesiones extensas, explicando los nombres primitivos de
consunción y de tisis. Puede haber fiebre de grado variable,
diaforesis nocturna, astenia, baja de peso, etc. Muchas veces
este último es más bien expresión de la
condición social y biológica que permitió
la reinfección. Debe tenerse presente que el compromiso
del estado general y fiebre pueden ser las únicas manifestaciones
clínicas, especialmente en ancianos, los que pueden no
tener síntomas de localización respiratoria. Por
este motivo, en este grupo con cierta frecuencia el diagnóstico
de tuberculosis activa sólo se realiza postmortem.
e) Disnea: se
presenta en algunas lesiones avanzadas y puede deberse a trastornos
restrictivos por destrucción de parénquima o fibrosis
retráctil pleuropulmonar. En la tuberculosis miliar se
observa disnea como efecto de la rigidez pulmonar y del trastorno
de difusión por infiltración difusa, que en las
formas agudas a veces precede a la imagen radiográfica.
Ocasionalmente se observa un síndrome bronquial obstructivo
tardío en pacientes con cicatrices retractiles extensas,
que se presume ligado a secuelas de compromiso bronquial
y bronquiolar.
f) Examen físico:
es, en la mayoría de los casos, inespecífico o
normal, aun en presencia de lesiones importantes.
g) Síndromes
pleurales: pueden deberse a un derrame serofibrinoso, relativamente
frecuente, o a un empiema tuberculoso de baja incidencia, como
veremos en el capítulo correspondiente.
h) Secuelas de la
tuberculosis: la mayor parte de las veces son cicatrices
fibrosas, sin mayor trascendencia, pero también pueden
abarcar segmentos o lóbulos, retrayéndolos a un
nódulo o lámina (Figura 31-4).
Figura
31-4. Secuelas de tuberculosis. Se observa disminución
de volumen del lóbulo superior que se manifiesta por
el ascenso de la cisura horizontal, el hilio derecho y el
hemidiafragama derecho con desviación ipsilateral de
la tráquea. El lóbulo atelectásico muestra
una condensación no homogénea y engrosamiento
de la pleura apical.
Ocasionalmente las cicatrices pueden comprometer todo un hemitórax
o gran parte de ambos. En estos casos se asiste a una insuficiencia
respiratoria grave, que puede llegar al corazón pulmonar
por destrucción de lecho capilar pulmonar e hipoxemia.
En los procesos fibróticos es usual que se desarrollen
bronquiectasias, que, si son de los lóbulos superiores,
no acumulan secreciones y generalmente no causan problemas.
En otros lóbulos pueden dar origen a procesos supurativos
crónicos . Ocasionalmente, las cavernas pueden esterilizarse
y quedar abiertas para constituir residuos radiográficos
sin mayor trascendencia o ser origen de hemoptisis, abscesos
por invasión bacteriana o ser colonizadas por Aspergillus
spp, dando origen a masas de hongos (aspergilomas), que
suelen causar hemoptisis masivas
EXAMENES AUXILIARES
BACTERIOLOGIA DE EXPECTORACION
Es el método esencial
para el diagnóstico etiológico. Por su bajo costo,
alta especificidad y buena sensibilidad, se ha constituido en
el principal método de pesquisa de casos de TBC. En el
caso individual no deben escatimarse esfuerzos para obtener
muestras adecuadas y resultados fidedignos. Dada su importancia,
este aspecto se analizará en mayor detalle a propósito
del proceso diagnóstico.
La baciloscopía
(tinción de Ziehl-Nielsen) es la técnica de rutina
y herramienta fundamental para el diagnóstico de la tuberculosis
pulmonar que permite identificar bacilos alcohol-ácido
resistentes (BAAR) en múltiples muestras biológicas
(expectoración, orina, líquido cefalorraquídeo,
líquido peritoneal, líquido articular, biopsias).
Es sencilla, rápida, de bajo costo y amplia cobertura.
Su mayor inconveniente está en su sensibilidad de alrededor
de 66% ya que se requieren 5.000 a 10.000 bacilos por mililitro
de expectoración para que sea positiva. Su especificidad
es cercana a 100%.
El cultivo de Koch es
el método bacteriológico más sensible (90%)
y específico para detectar el Mycobacterium tuberculosis
(permite diagnosticar la enfermedad aun en pacientes que tienen
una escasa eliminación bacilar). Su principal inconveniente
es la lentitud en el desarrollo de las colonias, que habitualmente
requiere treinta a sesenta días de espera. Es un procedimiento
diagnóstico de mayor complejidad y costo relativo, que
requiere 500 a 1.000 bacilos por mililitro de expectoración
para que sea positivo. Se recomienda efectuar cultivo de Koch
en las siguientes condiciones clínicas:
a) En la pesquisa de "sintomáticos respiratorios,
a lo menos en una de las dos muestras de expectoración
.
b) En forma selectiva, cuando se estima que existe una población
bacilar escasa en las siguientes situaciones: muestras de expectoración
provenientes de pacientes con imágenes pulmonares patológicas
y baciloscopías de pesquisa negativas; muestras de contenido
gástrico o de expectoración inducida; en pacientes
con imágenes pulmonares patológicas y sin expectoración
espontánea; en toda muestra de procedencia extrapulmonar;
en la investigación de la tuberculosis infantil; en el
estudio de contactos sintomáticos; en la investigación
de TBC en personas VIH (+) o con SIDA, y en la investigación
de tuberculosis en personal de salud
c) En pacientes con
antecedentes de recaídas o abandono de tratamiento anti-TBC.
d) Cuando está indicado realizar estudio de susceptibilidad
y/o tipificación de micobacterias.
El estudio de tipificación
de micobacterias completa el estudio diagnóstico y debe
efectuarse en las siguientes situaciones:
- Cuando en el laboratorio se sospecha
la presencia de una micobacteria no tuberculosa en el cultivo
por cromogenicidad, desarrollo rápido o anormalidad
de las colonias.
- En todo cultivo positivo de orina.
- En todo cultivo positivo de ganglios
o tejido óseo, en menores de 15 años.
- En casos de tuberculosis asociada
a VIH/SIDA.
- En casos que presentan polirresistencia
a las drogas antituberculosas.
El estudio de susceptibilidad
a antibióticos no tiene indicación en el momento
del diagnóstico del caso individual. Sólo debe
efectuarse en:
- Casos con antecedentes de uno o más
tratamientos: recaídas y abandonos recuperados.
- Casos de tuberculosis asociada a
VIH o SIDA.
- En contactos de pacientes con multirresistencia
demostrada.
- En enfermos procedentes de países
con alta prevalencia de TBC.
- En personal de salud con tuberculosis
confirmada bacteriológicamente.
La limitada
sensibilidad de le baciloscopia en caos leves y medianos y la
demora del cultivo han estimulado en la última década
la investigación metódica de métodos mas
eficaces. Si bien se han desarrollado algunos ninguno ha logrado
por el momento constituirse en un método rutinario y masivo,
ya sea por su alto costo, complejidad o facilidad de contaminación.
RADIOLOGIA
Hace algunas décadas
la radiografía fue utilizada para la pesquisa de casos
de TBC, pero el alto costo de su empleo masivo no fue compensado
con un rendimiento adecuado. Las limitaciones inherentes a la
lectura de las radiografías y el desarrollo de lesiones
en los períodos entre los exámenes explican esta
ineficiencia. No obstante, es el método de elección
para cuantificar la extensión lesional en el caso individual,
y es frecuentemente el punto de partida del estudio de pacientes
que consultan por síntomas respiratorios inespecíficos.
El aspecto radiográfico
puede ser realtivamete característico,pero su especificidad
es baja.. Se observan áreas de condensación no
homogénea, que pueden tener una distribución segmentaria
o no segmentaria, y que compromete con mayor frecuencia el segmento
apical o posterior de lóbulos superiores o el apical
del inferior (Figura 31-5). Obviamente, otras localizaciones
no permiten descartar la TBC. Las lesiones suelen mostrar disminución
de volumen del pulmón afectado, la que en ocasiones puede
ser muy acentuada. Es frecuente observar cavidades, que en la
mayoría de los casos no muestran niveles hidroaéreos
en su interior. En inmunosuprimidos pueden observarse falsos
negativos,

Figura
31-5. Tuberculosis activa. Se aprecia una condensación
en el lóbulo superior derecho con una caverna en
su interior. Exista una moderada reducción de volumen,
manifestada por el ascenso de la cisura horizontal, y un
engrosamiento de la pleura apical.
En los casos que existe
diseminación por vía bronquial, la enfermedad
se extiende con lesiones similares a la mayor parte de ambos
pulmones.
En la diseminación
hematógena las lesiones consisten en innumerables nódulos
pequeños, muy bien delimitados, que son relativamente
característicos de esta enfermedad (Figura 31-6).

Figura
31-6. Tuberculosis miliar. Se observan múltiples
nodulillos claramente delimitados y diseminados homogéneamente
en ambos pulmones.
Ocasionalmente es posible
observar un nódulo pulmonar de algunos centímetros
de tamaño, denominado tuberculoma, que se presta a confusión
con cáncer bronquial, del que se puede diferenciar radiográficamente
si presenta calcificaciones centrales.
Aun cuando muchas lesiones
son altamente sugerentes, el diagnóstico debe siempre
confirmarse mediante métodos bacteriológicos.
El aspecto de las lesiones no permite afirmar la actividad de
la enfermedad, ya que las lesiones inactivas, sin gérmenes,
pueden producir imágenes radiográficas similares
a las activas. Una excepción relativa a esta regla es
la imagen radiográfica de tuberculosis miliar, que autoriza
a iniciar un tratamiento sin esperar confirmación bacteriológica.
Bajo tratamiento la regresión de las imágenes
es lenta de manera que no se justifican controles radiológicos
antes de 6 meses, salvo síntomas de arma,
HEMOGRAMA Y SEDIMENTACION
Su alteración
es tardía e inespecífica y no contribuye al diagnóstico
etiológico.
PPD
En nuestro país
carece de utilidad diagnóstica por la alta proporción
de infectados no enfermos y el uso extenso de BCG. Hacen excepción
a esta regla la comprobación de un viraje reciente a
cualquier edad y la reacción positiva bajo los 4 años
en niños no vacunados, condiciones en que la prueba positiva
se considera suficiente para iniciar un tratamiento anti TBC.
Un 10 a 15% de las TBC pueden tener PPD negativo por la existencia
de una anergia que facilitó el desarrollo de la enfermedad
BIOPSIAS
Ocasionalmente se recurre
a biopsias pulmonares por especialmente cuando en el diagnóstico
diferencial cabe la posibilidad de cáncer o es necesario
aclarar la etiología de una lesión micronodular
diseminada. Es un método muy utilizado en lesiones extrapulmonares
como pleura, ganglios, hueso, piel, etc. La sensibilidad de
cultivos de biopsias es muy satisfactoria.
TECNICAS DE BIOLOGIA
MOLECULAR
Como alternativas a la
baciloscopia por microscopía y a la lentitud del cultivo
en medio Lowenstein-Jensen han surgido diversos métodos
de amplificación de ácidos nucleicos.
La reacción en
cadena de la polimerasa permite una identificación más
rápida del complejo M. tuberculosis y es empleada
para amplificar el material genómico (DNA) de una muestra
clínica (expectoración, líquido pleural,
tejido pulmonar, pleural, meninges, etc.). Aplicada en una muestra
de expectoración puede entregar un resultado en 48 horas.
En el contexto de sospecha clínica alta o intermedia
de TBC, la sensibilidad de la PCR es de 75-88% y la especificidad
de 100%. Aunque se necesitan más estudios para evaluar
el papel de la PCR, parece razonable solicitarla en caso de
alta sospecha clínica y baciloscopías negativas.
Las técnicas de
biología molecular se pueden utilizar en el proceso diagnóstico
de la infección tuberculosa pulmonar y extrapulmonar
no bacilífera, en la pesquisa y caracterización
molecular de los microorganismos resistentes a los antimicrobianos
y en los sistemas de vigilancia epidemiológica (epidemiología
molecular) para identificar las distintas cepas micobacterianas
que afectan a la comunidad.
PROCESO DIAGNÓSTICO
El énfasis se
centra en buscar al enfermo más que en esperar su consulta
ya que, por una parte, el caso no diagnosticado disemina la
infección y por otra, existe una terapia altamente eficaz
que evita las muertes y el contagio de nuevos casos. Esto implica
una seria responsabilidad médica en la omisión
diagnóstica
El aislamiento del bacilo de Koch mediante la bacteriología
o la demostración de su presencia a través de
la histopatología constituye la certificación
del diagnóstico de la tuberculosis. Procedimientos como
la radiología, exámenes bioquímicos de
laboratorio, la reacción tuberculínica, la historia
clínica u otros, pueden sugerir el diagnóstico,
pero éste debe confirmarse con la demostración
del Mycobacterium tuberculosis. El cumplimiento de esta
obligación diagnóstica significa:
a) Permanente conciencia de la alta probabilidad de esta afección
en nuestro medio, con búsqueda activa ante cualquier
elemento de sospecha.
b) Acatamiento riguroso de las normas diagnósticas y
terapéuticas del Programa Nacional de Control de la Tuberculosis.
c) Referencia del paciente a los centros establecidos en el
caso de no estar capacitado o equipado para el estudio y tratamiento
de la enfermedad.
En la mayoría
de los casos esto se logra mediante la simple baciloscopía.
La mejor muestra es la primera expectoración matinal,
que permite diagnosticar aproximadamente el 76% de las TBC bacilíferas.
Si este examen es negativo, un segundo espécimen logra
identificar un 7% adicional. La solicitud de otras muestras
no se justifica rutinariamente, ya que contribuye poco a pesquisar
nuevos casos. Por esta razón, el Programa Nacional recomienda
solicitar dos baciloscopías de esputo a los "sintomáticos
respiratorios", que son los consultantes a los servicios
de salud por cualquier problema y que, al ser interrogados dirigidamente,
relatan presentar tos con expectoración por más
de dos semanas o expectoración hemoptoica.
En pacientes sintomáticos
respiratorios mayores de 50 años, grupo con mayor riesgo
de desarrollar TBC pulmonar, se recomienda efectuar una radiografía
de tórax en dos proyecciones.
Obviamente, cuando la
anamnesis y el examen físico son sugerentes de TBC pulmonar,
se debe solicitar una radiografía de tórax simultáneamente
con las baciloscopías. Como una extensión a la
localización de casos, se recomienda incluir la investigación
de tuberculosis en los pacientes infectados por el VIH y en
los contactos de enfermos tuberculosos pulmonares bacilíferos.
El cultivo de Koch, por
su mayor sensibilidad, permite diagnosticar un elevado porcentaje
de los pacientes con TBC pulmonar no identificados por la baciloscopía.
En estos enfermos poco bacilíferos y con una enfermedad
de curso subagudo, la espera del resultado de los cultivos no
significa problemas para el paciente ni su familia, ya que son
poco contagiosos, por lo que generalmente no necesitan ser tratados
mientras no se confirme el diagnóstico. Además,
durante este lapso pueden repetirse las baciloscopías
para detectar la aparición de una eventual positividad
de este examen, o nuevas radiografías para vigilar la
progresión de la lesión sospechosa.
Por otra parte, existen
pacientes con diagnóstico radiográfico y clínico
presuntivo de TBC pulmonar cuyas baciloscopias resultan repetidamente
negativas, y en quienes urge iniciar tratamiento por su gravedad
o condiciones patológicas asociadas. En estos enfermos
se pueden obtener muestras de lavado bronquial o broncoalveolar
mediante una fibrobroncoscopia para nuevos cultivos de expectoración.
Además, deben solicitarse baciloscopias de expectoración
post-broncoscopia, que tienen alta sensibilidad, pues el procedimiento
endoscópico suele permeabilizar el bronquio tributario
de la lesión TBC.
Un pequeño número
de pacientes con lesiones radiográficas sugerentes de
TBC pulmonar no tienen tos productiva, lo que dificulta su estudio.
En estos casos puede intentarse la kinesiterapia con tos asistida,
especialmente después de nebulizar una solución
hipertónica de NaCl al 10%. También es posible
efectuar una fibrobroncoscopía o, si no se dispone de
este método, realizar baciloscopías y cultivos
del contenido gástrico en ayunas, que suele contener
bacilos deglutidos durante la noche.
En un limitado número
de enfermos puede ser necesario iniciar un tratamiento anti
TBC sin confirmación bacteriológica. La mayor
parte de éstos son TBC miliares, en las cuales los granulomas
son intersticiales y, por lo tanto, "cerrados". En ellos la
gravedad de la enfermedad obliga a iniciar el tratamiento anti-TBC
sin esperar el resultado de los cultivos, que pueden ser también
negativos. El diagnóstico en estos casos también
puede confirmarse con una biopsia pulmonar transbronquial o
biopsia hepática. Por otra parte, el hallazgo de tubérculos
coroideos en el fondo de ojo es muy sugerente de TBC miliar.
Finalmente, existen otros enfermos que deben ser tratados sin
confirmación bacteriológica, conducta que debe
ser discutida con médicos con experiencia en la materia.
En la Figura 31-7 se
esquematiza estas conductas del estudio.

Figura
31-7. : Esquema de toma de decisiones en el enfrentamiento
de la tuberculosis.
El examen histopatológico
de biopsias tiene su principal indicación en las localizaciones
extrapulmonares de la tuberculosis.
En los sintomáticos
respiratorios con persistencia de su sintomatología y con
baciloscopías negativas se recomienda realizar el siguiente
proceso diagnóstico:
a) Practicar estudio radiológico de tórax: si se
demuestra la presencia de imágenes patológicas pulmonares,
debe efectuarse un nuevo estudio bacteriológico, incluyendo
el cultivo de todas las muestras de expectoración.
b) Donde no se pueda efectuar el examen radiológico, repetir
dos series de baciloscopías quincenales. Si con el conjunto
de estos procedimientos no se logra establecer el diagnóstico
de la enfermedad tuberculosa activa, el caso debe referirse al
especialista para un mayor estudio e investigación de otras
etiologías.
PRONOSTICO
La larga historia de esta
grave enfermedad sin que existiera una terapia eficaz explica
el sombrío pronóstico que aún se le atribuye.
Es importante que tanto en el ambiente médico como público
se tenga claro que:
a) La tuberculosis es
una afección totalmente curable, salvo casos terminales.
b) Los fracasos rara vez se deben a la enfermedad misma o a ineficacia
de la terapia: la gran mayoría de las veces corresponden
a pacientes que no cumplen el tratamiento o al médico que
lo indica mal.
c) En los pacientes que cumplen su tratamiento, el pronóstico
es excelente, ya que la curación es del orden de 99% y
la tasa de recaídas de aproximadamente 1%.
TRATAMIENTO
En este aspecto lo esencial
no es memorizar las dosis y esquemas, que siempre pueden ser consultados
si se han olvidado, sino que comprender e interiorizar los conceptos
y hechos que fundamentan la conducta terapéutica.
Cuando se comenzó
a utilizar la estreptomicina en 1944 se constató que, para
obtener algún resultado, era necesario efectuar tratamientos
prolongados, ya que con los de corta duración se producían
recaídas precozmente. También se apreció que
el antibiótico perdía su eficacia en algunos casos,
pues el BK se hacía resistente a su acción. Más
adelante se comprobó que la aparición de resistencia
podía prevenirse si se utilizaba una segunda y, mejor, una
tercera droga anti-TBC.
En esta etapa, los tratamientos
eran altamente eficaces y curaban a una elevada proporción
de los pacientes tuberculosos que los seguían correctamente.
Sin embargo, muchos pacientes no sanaban debido a irregularidad
en su cumplimiento. Nació entonces el concepto de tratamiento
supervisado, en que la administración de las drogas era controlada
por personal entrenado. Toda esta experiencia permitió definir
los siguientes principios básicos de tratamiento:
- Debe ser prolongado por un tiempo
suficiente, variable según el esquema de drogas utilizado,
para evitar las recaídas.
-
Debe
ser asociado, incluyendo en cada esquema tres a cuatro
drogas anti-TBC eficaces para evitar la aparición de
resistencia bacteriana. Se puede disminuir sólo en
casos especiales determinados por un especialista)
- Debe ser supervisado por personal
entrenado para asegurar la correcta administración
de los medicamentos, lo que significa que el paciente debe
concurrir a los centros de tratamiento del Sistema Nacional
de Servicios de Salud, Hay estudios que demuestran que alrededor
de la mitad de los pacientes que, por considerarse confiables
, han sido autorizados a seguir un tratamiento auto-controlado
no se atienen rigurosamente a la pautas indicadas.
De acuerdo a estas bases
se investigó y se puso en práctica regímenes
de tratamiento altamente eficaces, capaces de mejorar al 100%
de los pacientes que iniciaban tratamiento con gérmenes
sensibles a las drogas utilizadas. Para los fracasos por resistencia
bacteriana se diseñaron esquemas de segunda y de tercera
líneas, que eran también útiles, aun cuando
de mayor toxicidad. En la última década, el conocimiento
de los mecanismos de acción de las drogas anti-TBC ha
permitido revolucionar el tratamiento lográndose esquemas
aun más eficientes pese a su menor duración.
Toda persona diagnosticada
de tuberculosis debe iniciar tratamiento con el esquema diferenciado
apropiado a su condición. Los esquemas son asociaciones
de medicamentos, de probada eficacia, establecidos por norma,
que se deben respetar rigurosamente para evitar las medicaciones
espontáneas o mal fundamentadas. Los tratamientos se
administran diaria o intermitentemente, debiéndose mantener
por 6 o 9 meses. Es crucial mantener la adherencia al tratamiento
y supervisar la ingesta de medicamentos.
En la experiencia mundial,
sólo el programa de tratamiento asociado, controlado
y supervisado (Directly observed treatment, shortcourse en ingles
DOTS). ha sido capaz de ofrecer una organización, que
permita resultados apreciables en este sentido. Por cierto que
un elemento que garantiza la cobertura diagnóstica y
la adherencia al tratamiento es la gratuidad de la atención
para hacer la pesquisa y tratamiento de los enfermos de tuberculosis.
De lo expuesto puede
quedar la impresión de que el problema TBC es fácilmente
solucionable por las altas probabilidades de curación
que ofrece el tratamiento ante un paciente recién diagnosticado.
Sin embargo, esto es válido sólo para el caso
individual pero falla en el problema poblacional pro múltiples
razones:
-
. Muchos
de los pacientes se diagnostican tardíamente, después
de un largo período de tos con expulsión de
bacilos, durante el cual han contagiado a nuevos individuos
susceptibles que eventualmente enferman, manteniendo la endemia.
-
. Un
significativo porcentaje de los enfermos que inician un tratamiento
anti-TBC abandona antes de finalizarlo. Si bien algunos de
ellos curan, pese a no haber completado la terapia, otros
recaen y continúan siendo fuentes de contagio para
los individuos susceptibles
-
. Existen
países que no han establecido un sistema eficaz de
control por lo que no se cumplen las normas diagnósticas
y terapéuticas y , paradójicamente, existe una
tendencia muy extendida de los gobiernos a reducir los recursos
de los programas de control cuando éstos empiezan a
lograr éxito, suponiendo que la tuberculosis ya ha
sido derrotada. . Las actuales facilidades de desplazamiento
y las migraciones masivas facilitan que el contagio tienda
a la globalización.
Antes de analizar los
diferentes esquemas de tratamiento anti-TBC se revisarán
algunos aspectos bacteriológicos que han permitido su
formulación.
SUBPOBLACIONES BACILARES
En una lesión
tuberculosa cavitaria existen por lo menos dos subpoblaciones
bacilares que pueden diferenciarse claramente.
• Bacilos extracelulares:
ubicados en el tejido conectivo, tienen un ambiente ideal para
su reproducción: alta PO2 y pH alcalino. La mayor parte
de los BK de un paciente con TBC pulmonar cavitaria son extracelulares,
calculándose su número en aproximadamente 108
microorganismos por cavidad.
Bacilos
intracelulares: son aquellos fagocitados por los macrófagos,
por lo que se encuentran dentro de fagolisosomas, donde están
sometidos a la acción de enzimas que tratan de destruirlos,
con baja PO2 y pH ácido. Estos bacilos son menos numerosos
y están en malas condiciones para reproducirse, por
lo cual permanecen en condiciones metabólicas menos
activas.
Las drogas utilizadas en el tratamiento anti-TBC actúan
con diferente intensidad sobre estas subpoblaciones bacilares:
La estreptomicina (S), por ejemplo,
es bactericida contra los BK extracelulares, pero lo es muy
poco contra los intracelulares, pues la droga es menos activa
en pH ácido.
La pirazinamida (Z), en cambio, prácticamente
no actúa sobre los gérmenes extracelulares, pero
es bactericida para los intracelulares, ya que se activa en
pH ácido.
La isoniacida o HIN (H) y la rifampicina
(R) actúan sobre ambas subpoblaciones.
Otras drogas anti TBC, como etambutol
(E), cicloserina (Cs), kanamicina (K), etionamida (Et), tiacetazona
(TB1), ácido paraminosalicílico (PAS), sólo
son bacteriostáticas y se utilizan en algunos esquemas
para evitar la aparición de cepas mutantes resistentes
a las drogas bactericidas.
En la primera fase del
tratamiento antituberculoso existe una alta población
de bacilos extracelulares que son fácilmente eliminados
por las drogas anti-TBC. Se calcula que aproximadamente 3/4
del total de los bacilos son eliminados en los primeros dos
días de tratamiento, lo que explica la rapidez con que
los enfermos dejan de contagiar (10 días) y la mejoría
clínica observada al comienzo de la quimioterapia. En
este sentido la droga más activa es la isoniacida, cuya
acción es aumentada por las otras drogas anti-TBC.
Durante los siguientes
días la mayoría de los bacilos son destruidos
y sólo sobreviven aquellos que están metabólicamente
inactivos o muy poco activos. Estos bacilos pueden ser eliminados
por las drogas que actúan en el ambiente intracelular:
HIN y, especialmente, Z y R. Se cree que una pequeña
proporción de BK están en actividad metabólica
tan deprimida que no son afectados por ninguna droga anti-TBC,
lo que explicaría las ocasionales recaídas observadas
después de terminado un tratamiento.
El tratamiento de la
tuberculosis en todas sus formas se sustenta hoy en la quimioterapia
abreviada. Al igual que todas las acciones del Programa de Control
de la Tuberculosis, el tratamiento es gratuito para todos los
enfermos. La administración del tratamiento es preferentemente
ambulatoria y controlada, es decir directamente observada o
supervisada por el personal de salud y, en casos excepcionales,
por otras personas capacitadas a quienes se encomiende esta
responsabilidad. Las drogas se deben administrar todas juntas,
de una vez, en el tiempo que el enfermo necesite para ello,
y se debe evitar fraccionar la dosis diaria en horas separadas.
En general, todos los
esquemas constan de dos fases: una inicial intensiva, diaria,
destinada a eliminar rápidamente la mayor cantidad posible
de BK. La segunda fase es de menor intensidad, pues utiliza
menos drogas y/o en forma intermitente, y tiene como propósito
eliminar los gérmenes persistentes.
Los hechos expuestos
explican por qué los antiguos esquemas debían
ser prolongados por 12 a 24 meses. Si bien el tratamiento era
capaz de eliminar rápidamente la gran mayoría
de los gérmenes (H-S), estos esquemas no incluían
drogas que actuaran eficazmente sobre los gérmenes persistentes
(R o Z), por lo que la eliminación de estos bacilos era
lenta. Los esquemas acortados de hoy, eliminan en forma eficiente
no sólo los bacilos extracelulares, sino que también
los intracelulares persistentes, con lo que el tratamiento puede
acortarse a seis meses sin perder su eficacia.
RESISTENCIA BACTERIANA
Es una eventualidad que
conviene tener presente en forma metódica ya que, a pesar
de todas las precauciones programáticas, sigue siendo
un problema en actividad.
Si se efectúa
un tratamiento anti-TBC con una sola droga (monoterapia) a un
paciente con TBC cavitaria, se observa, que después de
un período inicial de mejoría sigue una agravación
con reaparición de las baciloscopías positivas
y extensión de las lesiones pulmonares. Esta evolución
se debe a que en las poblaciones bacilares numerosas existe
una determinada proporción de BK mutantes, resistentes
en forma natural a un determinado quimioterápico, aun
cuando nunca hayan estado en contacto con éste. La monoterapia
elimina sólo a los gérmenes sensibles, disminuyendo
acentuadamente la población bacilar y, por lo tanto,
los síntomas de la enfermedad. Sin embargo, si el sistema
defensivo no es capaz de contener la multiplicación de
los mutantes resistentes, se produce la reagravación
antes descrita.
La proporción
de mutantes resistentes es variable para los diferentes quimioterápicos:
R = 1 cada 108; HIN, S, PAS, K, E = 1 cada 105
a 106; Et, Z, Cs, TB1 3= 1 cada 103. Dada
la elevada cantidad de bacilos presentes en una lesión
TBC cavitaria, existen numerosos gérmenes resistentes
a por lo menos un quimioterápico.
El problema de la resistencia
bacteriana se acentuó durante los primeros años
de tratamiento anti-TBC debido a que, por desconocimiento del
problema, se efectuaba monoterapia, lo que motivó una
selección de mutantes resistentes que se hicieron más
numerosos al producirse primoinfecciones con estas cepas. Por
ello la "resistencia primaria" (resistencia de los BK de pacientes
nunca antes tratados en Chile es de aproximadamente 10% para
la SS y 3,9% para la HIN.
En Chile, la resistencia
primaria de M. tuberculosis a drogas anti-TBC fue de
10,8% en el 2001; la multirresistencia (resistencia a isoniacida
y rifampicina a la vez, con o sin resistencia simultánea
a otras drogas esenciales) fue de 0,7%, y la resistencia global
adquirida de 20,5%.
La monoterapia puede
producirse por varios mecanismos y no siempre es evidente :
a) Falla en la prescripción
de los antimicrobianos:
- Se indica una sola droga.
- Se indica una droga diaria y otra
intermitente.
- Se indican dosis insuficientes.
b) Mal cumplimiento
de las indicaciones: el paciente ingiere sólo una de
las drogas prescritas.
c) Resistencia primaria a drogas en tratamientos
asociados. Por ejemplo, si los BK de un paciente tratado con
S - HIN son resistentes a S, la única droga eficaz
es HIN. Por lo tanto, en este caso se está efectuando
"monoterapia encubierta" con HIN. Este tipo de monoterapia
puede evitarse siguiendo estrictamente las normas del programa,
que preconiza utilizar cuatro drogas en la fase inicial, durante
la cual es más probable este problema por el mayor
número de gérmenes.
d) resistencia secundaria, en casos que han
seleccionado cepas resistentes por alguno de los mecanismos
anteriores.
El manejo de los pacientes con resistencia
al tratamiento corresponde al especialista, quien deberá
seleccionar las drogas que tengan escasa probabilidad de resistencia
en ese caso particular. Estas pueden identificarse mediante
estudios de sensibilidad y efectuando una cuidadosa historia
de los tratamientos previos. Es conveniente tener presente
que, debido al limitado número de drogas anti-TBC,
la selección de un esquema equivocado puede determinar
que los gérmenes se hagan resistentes a todas ellas,
con lo que el paciente queda sin posibilidad de efectuar quimioterapia.
ESQUEMAS ESTANDARIZADOS DE TRATAMIENTO
Por las razones enunciadas queda clara la
necesidad de uniformar el tratamiento anti-TBC con esquemas
ampliamente probados en cuanto a su eficacia, aceptabilidad,
efectos secundarios, costo, etc. Los esquemas estándar
permiten uniformar criterios, obtener experiencias comparables,
facilitar la supervisión y delegar funciones.La estrategia
que actualmente recomienda la Organización Mundial
de la Salud es conocida como DOTS , sigla de la designación
en ingles de Directly Observed Treatment, Short-course. Es
importante considerar que, manteniéndose dentro de
las bases fundamentales de esta estrategia. los esquemas de
tratamiento pueden variar en los diferentes países,
dependiendo de los niveles de resistencia primaria. Por lo
tanto, no es recomendable copiar esquemas extranjeros que
pueden no ser aplicables a la realidad nacional. El Ministerio
de Salud ha establecido tradicionalmente esquemas que, partiendo
de la experiencia e investigación internacional, han
demostrado ser los más eficaces en nuestro país.
Actualmente se utiliza un esquema abreviado
de seis meses de duración (Tabla 31-1), producto de
la experiencia nacional de los últimos años.
Dado que la disponibilidad de especialistas es limitada, en
la gran mayoría de los casos la aplicación del
esquema básico corresponde a médicos generales
que, para este efecto, deben incorporarse a las estructuras
locales del Programa Nacional de Control de la Tuberculosis
y guiarse por sus pautas. El sistema es eficiente para la
gran masa de los pacientes, pero el médico debe estar
preparado para recurrir a los mecanismos de referencia establecidos
cada vez que el caso se salga de lo usual.
Se utilizarán regímenes de
quimioterapia diferenciados de acuerdo a la clasificación
de los enfermos, distinguiéndose para los casos nuevos
un esquema primario y otro primario simplificado; un
esquema secundario para los pacientes antes tratados que consulten
nuevamente con baciloscopías positivas (recaídas
y abandonos de tratamientos anteriores); esquemas de retratamiento
para los enfermos multirresistentes y para los casos crónicos,
y esquemas diferenciados en situaciones especiales. Los esquemas
se designan por un código que separa etapas con un
/ e indica en números los meses de duración
de la etapa. Las drogas se anotan por sus iniciales. Así,
2HRZE/4H2R2 , indica una etapa inicial de 2 meses con cuatro
drogas diarias y una segunda etapa de 4 meses con HIN 2 veces
por semana y Rifampicina con igual periodicidad. Las dosis
diarias se administran por 5 días seguidos cada semana
Esquema primario
Los enfermos nuevos, también llamados
vírgenes de tratamiento, con tuberculosis pulmonar
o extrapulmonar confirmada bacteriológicamente por
baciloscopía o el cultivo, tienen la más alta
prioridad, tanto por su gravedad y riesgo de morir, como por
constituir las fuentes de transmisión de la enfermedad.
Recibirán el esquema primario: 2HRZE/4H2R2, con una
duración de 6 meses. El mismo tratamiento deberán
recibir los casos con enfermedad extensa, severa o de mal
pronóstico, aun cuando no tengan confirmación
bacteriológica.
A los pacientes con tuberculosis pulmonar
cavitaria al inicio, que mantengan baciloscopías o
cultivos positivos al segundo mes de tratamiento, se les deberán
administrar 40 dosis bisemanales en vez de 32, prolongándose
por lo tanto la duración del tratamiento a siete meses.
|
Tabla 31-1 Tratamiento
de la tuberculosis pulmonar o extrapulmonar con bacteriología
positiva
|
| Drogas |
Fase diaria*
50 dosis
2 meses-10 semanas
|
Fase
bisemanal
32 dosis
4 meses-16
semanas |
| Isoniacida |
300 mg |
800
mg |
| Rifampicina |
600 mg |
600
mg |
| Pirazinamida |
1.500 mg |
|
| Etambutol
|
1.200
mg |
|
* Para enfermos de 40-60
kg de peso. En enfermos de pesos inferiores a 40 kg
o superiores a 60 kg deben ajustarse las dosis por kg
de peso.
Esquema primario simplificado
Los pacientes nuevos
con tuberculosis pulmonar o extrapulmonar con bacteriología
negativa debido a sus características clínicas
de menor gravedad, de menor contagiosidad y de población
bacilar más escasa, recibirán un esquema primario
sin Etambutol con una duración de seis meses: 2HRZ/4H2R2.
Tabla
31-2.Tratamiento de la tuberculosis pulmonar o extrapulmonar
con bacteriología negativa |
| Drogas |
Fase
diaria*
10 semanas- 50 dosis
|
Fase
bisemanal
16 semanas - 32 dosis
|
| Isoniacida |
300 mg |
800 mg
|
| Rifampicina |
600 mg |
600 mg |
| Pirazinamida |
1.500 mg
|
|
*
Para enfermos de 40-60 kg de peso. En enfermos
de pesos inferiores a 40 kg o superiores a 60kg deben
ajustarse las dosis por kg de peso.
Esquemas secundarios
Los pacientes con
antecedentes de tratamientos anteriores comprenden dos grupos
muy
1.- Pacientes antes tratados con recaída y los abandonos
recuperados: Estos pacientes deben recibir el esquema secundario,
correspondiente a un tratamiento primario reforzado, en
número de drogas y en número de dosis, de
nueve meses de duración: 1HRZES/1HRZE/7H2R2E2. A
estos pacientes se les debe practicar de rutina un estudio
de sensibilidad a las drogas empleadas anteriormente al
inicio del tratamiento. Cuando se demuestre mantención
de sensibilidad a la isoniacida y rifampicina, se podrá
suprimir el etambutol en la fase bisemanal.
|
Tabla 31-3.Tratamiento
de la tuberculosis en enfermos antes tratados |
| Drogas |
Fase
diaria I*
25 dosis (1 mes) |
Fase diaria II*25 dosis (1
mes)
|
Fase
bisemanal.
56 dosis (7 meses) |
| Isoniacida |
300
mg |
300
mg |
800
|
| Rifampicina
|
600
mg |
600
mg |
600 |
| Pirazinamida
|
1.500
mg |
500
mg |
|
| Etambutol |
1.200
mg |
1200
mg |
2400
|
| Estreptomicina |
750
mg |
|
|
*Para
enfermos de 40-60 kg de peso. En enfermos de pesos inferiores
a 40 kg o superiores a 60 kg deben ajustarse las dosis
por kg de peso.
2- Portadores de tuberculosis multirresistente
y los casos crónicos, los fracasos confirmados de
los tratamientos primarios o secundarios: Estos enfermos
generalmente presentan multirresistencia en elevada proporción,
y deben ser derivados al médico neumólogo
encargado del Programa anti-TBC en el Servicio de Salud.
Para estos casos se utilizará un esquema normado
de retratamiento que consiste en la asociación de
tres drogas de uso excepcional, no empleadas en los tratamientos
primarios o secundarios: kanamicina (K), etionamida (Et)
y ciprofloxacina (Cp), además de dos drogas de primera
línea a las cuales exista baja probabilidad de resistencia
adquirida: Etambutol (E) y pirazinamida (Z), administradas
diariamente por un tiempo mínimo de tres meses. En
la segunda fase puede suspenderse la K y el E, pero intentando
mantener la Et como droga base, si su tolerancia lo permite.
El tiempo total de tratamiento será de 18 a 24 meses.
Se practicará una baciloscopía y cultivo mensualmente.
La etapa intensiva debe mantenerse hasta la negativización
del cultivo; después, deberá seguirse el tratamiento
un año más, para consolidación de los
resultados.
CONTROL DE TRATAMIENTO
Tiene como objetivos
evaluar la eficacia del tratamiento y detectar precozmente
las reacciones adversas a las drogas anti-TBC. La eficacia
del tratamiento se evalúa bacteriológicamente
con un control mensual de baciloscopía de expectoración.
Se recomienda, además, efectuar una radiografía
de tórax al comienzo y a los 6 meses de tratamiento,
para observar la regresión de las lesiones o para
detectar su progresión en casos de fracaso de tratamiento.
Controles durante
los tratamientos primarios y secundarios
El paciente debe
ser controlado mensualmente por el médico. El control
clínico tiene como objetivo detectar precozmente
manifestaciones de intolerancia, apreciar el estado general
del paciente, pesarlo para ajustar las dosis de medicamentos
si es necesario, y motivarlo para que no abandone el tratamiento
a pesar de la desaparición de los síntomas.
Durante el tratamiento se debe realizar una baciloscopía
mensual y un cultivo al segundo mes. Debe obtenerse una
muestra de expectoración mensual, aunque ésta
no sea de buena calidad. Es especialmente importante la
baciloscopía del 6° mes o al término del
tratamiento, para documentar la curación del paciente.
Se recomienda solicitar una radiografía de tórax
al iniciar el tratamiento y al finalizarlo, de acuerdo a
las disponibilidades del recurso. Después del alta,
sólo se efectuará bacteriología de
expectoración en aquellos pacientes en los que reaparezcan
los síntomas.
FRACASO
Bacteriológicamente,
el fracaso se caracteriza por persistencia o reaparición
de bacilos de Koch viables en la expectoración durante
el tratamiento. Se puede producir por los siguientes mecanismos:
a) Alta resistencia primaria.
b) Ingesta inadecuada de medicamentos.
c) Intermitencias en la administración por inasistencia,
incumplimiento o toxicidad.
Dado que es posible que las baciloscopías positivas
se deban a la eliminación de gérmenes muertos,
el fracaso debe siempre comprobarse con cultivo de Koch.
La evolución de las baciloscopias de control mensual
sugiere fracaso en las siguientes condiciones(Tabla 31-4):
a) Persistencia de baciloscopías
positivas hasta el cuarto mes.
b) Reaparición de dos baciloscopías
positivas o obtenidas en meses consecutivos con un cultivo positivo después de tener
baciloscopías negativas por lo menos durante dos
meses.
c) Cultivo negativo simultáneo
a una baciloscopía positiva, indica eliminación
esporádica de bacilos muertos.
Tabla
31-4-Criterios de fracaso de tratamiento antituberculosis
|
| Mes |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
a) Baciloscopía - cultivo
|
+ |
+ |
+ |
+ |
+
+ |
+ |
+ |
+ |
| b) Baciloscopía- cultivo |
+ |
+ |
- |
- |
+ |
+
+ |
+ |
+ |
| c) Baciloscopía- cultivo |
+ |
+ |
- |
- |
+
- |
- |
- |
- |
Cuando se sospecha
un fracaso, no se debe cambiar el esquema de tratamiento,
ya que las evoluciones descritas no siempre corresponden
a esta posibilidad. Una vez comprobado el fracaso con cultivo,
debe iniciarse un esquema de retratamiento que es dominio
del experto en TBC.
RECAIDAS
Se define como recaída
la reaparición de bacilos de Koch viables en expectoración
una vez finalizado exitosamente un tratamiento anti-TBC.
Al igual que en los fracasos, el diagnóstico debe
efectuarse con cultivo, pues es posible la eliminación
de gérmenes no viables, visibles en la baciloscopía,
aun después de terminado el tratamiento. El cultivo
de Koch debe solicitarse cuando dos baciloscopías
de expectoración de muestras separadas resultan positivas.
El mecanismo que
explica las recaídas es diferente del de los fracasos,
lo que tiene importantes implicaciones terapéuticas.
Las recaídas se deben a la multiplicación
de BK durmientes que persisten después de finalizado
el tratamiento. La mayoría de ellas ocurre en los
primeros seis meses después de la quimioterapia,
por lo que pueden ser detectadas fácilmente si se
realiza un control de seguimiento. En estos casos, el BK
es sensible a las drogas utilizadas y por ello las recaídas
se tratan reiniciando el mismo esquema, pero prolongando
la fase intermitente a 7 meses (2 HRZE/7 H2R2E2).
ABANDONO
Se define como la
inasistencia continuada por 4 semanas en la etapa diaria
o intermitente. Si estos enfermos se presentan nuevamente
a control, se debe efectuar una baciloscopia de expectoración
para decidir la conducta. Si la es positiva, se debe reiniciar
con el tratamiento secundario correspondiente a enfermos
antes tratados. Si baciloscopía es negativa y el
reingreso se produce en los primeros tres meses luego de
la interrupción del tratamiento, se recomienda completar
el número de dosis que faltaron. Si ocurre después
de 3 meses, se sugiere controlar con baciloscopías
y cultivos trimestrales, hasta completar 12 meses de observación.
No se debe reiniciar el tratamiento sin confirmación
bacteriológica.
TRASLADO
Corresponde a todo
enfermo referido a otra unidad o establecimiento de salud.
La unidad de destino debe informar al establecimiento que
refiere la recepción del paciente y, una vez finalizado
el tratamiento, la condición de término (curado,
fracaso, fallecido o abandono).
CASOS ESPECIALES
Tratamiento no controlado.
En pacientes que no pueden cumplir su tratamiento en forma
controlada, usualmente por condiciones de ruralidad, se
sugiere completar la primera fase de tratamiento con el
enfermo hospitalizado y continuar con el esquema intermitente
habitual, con entrega mensual de los medicamentos para autoadministración.
Embarazo. Se utilizan los mismos esquemas de tratamiento.
En ningún caso debe usarse estreptomicina por el
alto riesgo de ototoxicidad para el feto.
Tuberculosis en pacientes
con infección VIH/SIDA. Se tratan con los
esquemas primario o secundario, según corresponda.
En casos especiales, el médico tratante puede prolongar
los esquemas primarios a nueve meses. Una vez finalizado
el tratamiento, en prevención de recaídas
y como protección de reinfecciones, algunos expertos
recomiendan continuar con quimioprofilaxis secundaria con
isoniacida, 300 mg diarios, a permanencia, decisión
que corresponde al médico tratante de cada caso.
Considerando las interacciones entre la rifampicina y algunas
drogas antivirales, la planificación del esquema
terapéutico debe ser adaptada en conjunto por los
especialistas neumólogos e infectólogos de
referencia del programa y de CONASIDA, respectivamente.
El seguimiento y manejo general de los pacientes también
debe ser coordinado entre ambas especialidades.
Meningitis tuberculosa.
Se prescribe un esquema especial, con estreptomicina
en vez de etambutol, consistente en dos meses de SHRZ (50
dosis) seguido de cuatro meses de H2R2 (32 dosis) 2SHRZ/4H2R2.
Especialistas calificados, de referencia del programa, pueden
prolongar la duración total del esquema en casos
especiales.
Silicotuberculosis.
La TBC pulmonar en los enfermos de silicosis adquiere algunas
características especiales: la interpretación
radiográfica requiere de gran experiencia por la
preexistencia de sombras propias de la silicosis, la comprobación
bacteriológica es muchas veces muy difícil
y ocurren recaídas con frecuencia si no se prolonga
el tratamiento. Se recomienda utilizar el esquema primario,
prolongando su segunda fase a 10 meses: 2HRZE (50 dosis)/10
H2R2 (80 dosis) con una duración total de 12 meses.
Algunas investigaciones sugieren continuar después
con quimioprofilaxis permanente.
Insuficiencia
hepática. Debido a la posibilidad de agregar
un daño tóxico a un hígado alterado,
se recomienda cambiar el esquema de primera línea
por otro con menor probabilidad de provocar toxicidad hepática.
Los enfermos con insuficiencia hepática descompensada
en el momento del diagnóstico de su tuberculosis
recibirán un esquema especial, sin rifampicina ni
pirazinamida, de 18 meses de duración: 2 SHE (50
dosis)/16 E2H2 (128 dosis).
Insuficiencia
renal. Se recomienda utilizar los esquemas primario
o secundario según corresponda, en conjunto con los
especialistas, ajustando las dosis según el grado
de severidad de la insuficiencia renal, especialmente para
el etambutol, que, al igual que la estreptomicina, se excreta
por el riñón.
TBC extrapulmonar.
Todas ellas se tratan con el esquema primario o secundario
según se trate de casos nuevos, recaídas o
abandonos. Como excepción, las TBC ganglionares pueden
necesitar de un tratamiento más prolongado y, ocasionalmente,
de inyección local de drogas anti-TBC. En meningitis,
peritonitis y pericarditis tuberculosas y en las tuberculosis
pulmonares diseminadas, endobronquiales o con atelectasia,
se recomienda administrar corticosteroides: prednisona 1
mg/kg en adultos y 2 mg/kg en niños (dosis máxima:
40 mg diarios) durante 2 semanas, con reducción progresiva
de 10 mg por semana. En algunos casos de adenitis, espondilitis,
etc., puede ser necesario agregar un complemento quirúrgico
cuya indicación y oportunidad deben ser analizadas
con los especialistas.
|
Tabla 31-5. Drogas antituberculosas
|
Droga |
Dosis
diaria (mg/kg) |
Dosis
bisemanal (mg/kg) |
Presentación |
Observaciones |
| Estreptomicina
|
15(1) |
15
(1) |
Fcos.
1gr |
Inyectar
de inmediato |
| Isoniacida |
5
|
15
(2) |
Comprimidos
100mg |
|
| Rifampicina
|
10(2) |
10
(2) |
Cápsulas
150mg
Jarabe 100mg/5ml |
Tiñe
la orina de rojo |
| Pirazinamida
|
25(3) |
50
|
Comprimidos
500mg |
|
| Etambutol
|
20(4) |
50(5) |
Comprimidos
200mg |
|
| Etionamida
|
15
|
15
|
Comprimidos
250mg |
|
| Cicloserina
|
15
|
15
|
Cápsulas
250mg |
|
| Kanamicina
|
15(1) |
15(1) |
Fco.
1gr |
|
| Ciprofloxacina
|
15(6) |
15(6) |
Comprimidos
500mg |
|
(1) Dosis máxima de 1.000
mg. En mayores de 50 años: 500 mg dosis máxima
(2) Dosis máxima de 900 mg; (3) Dosis máxima
de 2.000 mg; (4) 15 mg/kg diarios después de los
primeros dos meses, cuando se siga administrando diariamente
(5) Dosis máxima bisemanal 3.500 mg (6) En el futuro
podrá ser reemplazado por otras quinolonas. Nota:
Al ajustar la dosis por kg de peso es recomendable elegir
la dosis superior más próxima a la calculada.
EFECTOS ADVERSOS
DE LAS DROGAS ANTI-TBC
Todas las asociaciones
de drogas antituberculosas pueden ocasionar efectos secundarios
indeseados, los que en una pequeña proporción
de enfermos pueden revestir gravedad, interferir en la regularidad
del tratamiento o favorecer el abandono. Cuando aparece
alguna manifestación indeseada durante un tratamiento
antituberculoso, lo primero que hay que establecer es si
ella se debe a alguno de los medicamentos administrados
o a un cuadro intercurrente. Una de las razones para mantener
el control mensual del enfermo es para detectar las manifestaciones
más importantes y frecuentes, que son la hepatitis
y reacciones alérgicas.
Con el esquema primario
con etambutol, isoniacida, rifampicina y pirazinamida, la
incidencia global de manifestaciones adversas, que obligan
a la suspensión de alguna de las drogas, oscila entre
2 y 3%. En unos pocos casos revisten especial gravedad.
El personal de salud debe tener presentes las reacciones
adversas a los medicamentos, saber reconocerlas, intentar
precisar el medicamento causal y referir al enfermo para
su inmediata atención a un nivel hospitalario. Es
importante tener presente que si bien las reacciones adversas
al tratamiento anti-TBC pueden ser analizadas para cada
droga en particular, es mejor hacerlo para cada esquema,
puesto que ocasionalmente se cometen errores de interpretación.
La pirazinamida, por ejemplo, fue considerada una droga
de alta toxicidad hepática, lo que llevó a
discontinuar su uso en Norteamérica. Sin embargo,
con las dosis actualmente utilizadas en el esquema primario
la hepatitis por esta droga es poco frecuente.
INTOLERANCIA DIGESTIVA
Es el efecto adverso más
frecuente , en general, se soluciona con cambios de horario,
administración de las drogas después de comidas,
uso de antiácidos, antieméticos o antiespasmódicos.
REACCIONES DE HIPERSENSIBILIDAD
En su mayoría son causadas por estreptomicina y
menos frecuentemente por rifampicina. Son relativamente
frecuentes y se manifiestan por lesiones dérmicas
de tipo urticarial, exantema morbiliforme o edema angioneurótico.
También puede haber anemias hemolíticas y
púrpura trombocitopénico por estas drogas
(S y R). Además, la rifampicina causa un cuadro parecido
a la influenza (flu syndrome), con fiebre, calofríos,
mialgias y malestar general, que se supone de origen inmunitario.
En general, ante reacciones de hipersensibilidad se suele
suspender la droga causante del problema, aunque en casos
de lesiones dérmicas leves se puede usar antihistamínicos.
El síndrome gripal puede resolverse con cambios en
la dosificación de la droga.
REACCIONES TOXICAS
Toxicidad VIII par
La estreptomicina puede
afectar la rama vestibular del nervio acústico con
trastornos del equilibrio, mareos, cefalea y vómitos.
Se producen con mayor frecuencia en sujetos mayores de 50
años por acumulación de la droga durante la
fase diaria. Es importante su pesquisa metódica, ya
que el trastorno es reversible si se detecta precozmente.
En cambio, si se continúa el tratamiento el compromiso
se hace irreversible y se puede agregar daño a la rama
coclear, ocasionando sordera.
Toxicidad hepática
HIN, R y Z pueden producir
hepatitis, que es la manifestación tóxica más
grave. Se observa elevación de transaminasas con aumento
de la bilirrubina y signos clínicos de hepatitis. El
compromiso hepático por HIN aparece corrientemente
al segundo o tercer mes de tratamiento. La hepatitis por R,
en cambio, es precoz, ya que se hace manifiesta a los 8 o
10 días. En estos casos es necesario suspender inmediatamente
el tratamiento.
Debe tenerse presente
que alrededor de un 20% de los pacientes con HIN tienen un
aumento transitorio y leve de las transaminasas. En estos
casos se recomienda suspender la droga sólo cuando
hay signos clínicos de hepatitis, si el aumento de
transaminasas es de 3 veces el valor normal o si hay aumento
de la bilirrubina o de la fosfatasa alcalina sérica.
Conviene notar que la R puede producir ictericia transitoria
por competencia en la captación y excreción
de la bilirrubina, fenómeno que no tiene trascendencia
patológica. Esta condición se diferencia de
la hepatitis por la ausencia de elevación de las enzimas
hepáticas en el suero. No se recomienda realizar rutinariamente
mediciones seriadas de la función hepática,
ya que ésta tiene una mala relación costo-beneficio
para la pesquisa de toxicidad hepática .
Polineuritis
Producida por HIN,
comienza generalmente con compromiso sensitivo de las extremidades
inferiores. Cede con piridoxina (vitamina B6), 25 mg diarios.
Algodistrofia
Es un trastorno músculo-esquelético
ligado al HIN por alteración del metabolismo del ácido
nicotínico. Se manifiesta por dolores musculares y
articulares. Se trata con nicotinamida y vitamina B6.
Parestesias bucales
Producidas por la estreptomicina,
son frecuentes al comienzo del tratamiento y no tienen mayor
significación patológica. Ceden con la administración
de antihistamínicos antes de la inyección de
la droga.
Misceláneas
Otros órganos
que pueden verse comprometidos por el tratamiento anti TBC
incluyen riñón (S); articulaciones (gota por
Z); nervio óptico (EMB), etc.
Las reacciones adversas
a los medicamentos antituberculosos más frecuentes
son:
Isoniacida:
hepatitis, polineuritis periférica, reacciones alérgicas.
Pirazinamida: hepatitis, dolores articulares
y gota, reacciones alérgicas.
Rifampicina: ictericia por interferencia con el metabolismo
de la bilirrubina, hepatitis con elevación de las transaminasas
(rara), reacciones inmunológicas: alergias, síndrome
gripal o síndrome febril con artralgias, alteraciones
hematológicas (trombocitopenia).
Estreptomicina: reacciones alérgicas, toxicidad
del VIII par (trastornos del equilibrio), toxicidad renal,
parestesias bucales.
Etambutol: neuritis óptica.
CONDUCTA FRENTE A
REACCIONES ADVERSAS GRAVES
La conducta general
es suspender todas las drogas y, una vez cedido el cuadro,
volver a administrarlas en dosis crecientes, excluyendo el
medicamento que con mayor probabilidad haya causado el problema.
Durante el período de prueba se debe controlar cuidadosamente
al enfermo, tratando de detectar precozmente la reaparición
de los síntomas, signos o alteraciones de laboratorio
propios de esa reacción adversa.
OTRAS MEDIDAS TERAPEUTICAS
Reposo. Antes
del desarrollo de la quimioterapia anti-TBC, el tratamiento
consistía en mejorar las condiciones del enfermo para
que su sistema inmunitario controlara la infección.
Para ello se ponía al enfermo en reposo en sanatorios
y era sobrealimentado. Estas medidas, que tenían algún
sentido en esa época, no son útiles actualmente,
pues las drogas anti-TBC curan igual al tuberculoso que hace
reposo que a aquellos que continúan trabajando. Actualmente,
el reposo se justifica sólo durante la fase inicial,
cuando hay síntomas importantes. En la gran mayoría
de los casos la sobrealimentación no es necesaria,
salvo que exista desnutrición, y la necesidad de hospitalización
es excepcional.
Aislamiento. El aislamiento del enfermo TBC de su familia
no tiene justificación, puesto que si existía
un sujeto susceptible en ella, lo más probable es que
se haya infectado antes de efectuarse el diagnóstico.
Además, una vez iniciado el tratamiento, el paciente
deja de contagiar en aproximadamente diez días. Existe
un caso especial, la embarazada con TBC pulmonar que tiene
su parto cuando aún es contagiosa. En estas pacientes
se recomiendan dos posibles conductas: a) Separar recién
nacido de su madre hasta que ella deje de contagiar y vacunarlo
con BCG, conducta poco recomendable a menos que la madre esté
muy enferma. b) No separarlo y hacer quimioprofilaxis con
HIN mientras dura el período contagioso. En este caso
debe esperarse el término de la quimioprofilaxis para
vacunar, pues el BCG es sensible a HIN.
QUIMIOPROFILAXIS
La quimioprofilaxis
consiste en la administración de isoniacida a personas
con riesgo de desarrollar una tuberculosis. En los contactos,
que son los mas frecuentes candidatos a quimioprofilaxis,
los elementos básicos para decidir son:
a) Estudio bacteriológico y localización de
la enfermedad en el caso índice (TBC pulmonar bacilífero).
b) Edad del contacto (menor de 5 años).
c) Seguridad de la ausencia de enfermedad tuberculosa activa
en el contacto (radiografía de tórax y examen
clínico negativo).
Se distingue entre la quimioprofilaxis primaria, que es aquella
que se indica a personas no infectadas, es decir PPD (-) para
protegerlas de la infección con el M. tuberculosis,
y la quimioprofilaxis secundaria, que es la que se administra
a individuos ya infectados, es decir PPD (+), para evitar
que desarrollen la enfermedad.
Indicaciones de
quimioprofilaxis primaria
a) Recién
nacidos de madre tuberculosa bacilífera, hayan o
no recibido BCG al nacer y sin evidencia clínica
ni radiológica de enfermedad tuberculosa.
b) Niños no vacunados con BCG, contactos de tuberculosos
bacilíferos, sin evidencia clínica ni radiológica
de TBC activa. Vacunar con BCG al término de la quimioprofilaxis.
Indicaciones de
quimioprofilaxis secundaria
a) Contactos intradomiciliarios,
menores de 5 años, de tuberculosos pulmonares bacilíferos,
con o sin cicatriz BCG y sin evidencias clínicas
ni radiológicas de enfermedad tuberculosa activa.
b) Infectados VIH/SIDA, según normas recomendadas
en el programa nacional y CONASIDA.
c) Individuos recientemente infectados (viraje tuberculínico
en los últimos dos años) o niños menores
de 5 años no vacunados con BCG.
d) Portadores de lesiones radiológicas inactivas,
consistentes con el diagnóstico de secuelas de tuberculosis
a la radiografía de tórax, con baciloscopías
y cultivos negativos y sin antecedentes de haber recibido
quimioterapia antituberculosa previa.
e) En situaciones clínicas especiales como las que
a continuación se enumeran, podrá emplearse
quimioprofilaxis por indicación médica individual:
diabetes, silicosis, gastrectomizados, enfermedades hematológicas
malignas, tratamiento inmunosupresor, insuficiencia renal
terminal y transplantados renales, drogadictos endovenosos,
terapias prolongadas con corticoides, enfermedades caquectizantes.
Contraindicaciones
de profilaxis
- Portadores de una enfermedad
tuberculosa activa.
- Individuos con antecedentes de
daño hepático secundario a isoniacida o
con historia de reacciones adversas a esta droga.
- La quimioprofilaxis con isoniacida
debe indicarse con precaución:
a) En individuos con más de 35 años de edad,
por el mayor riesgo de toxicidad hepática.
b) Frente al empleo de medicamentos que tengan interacción
con la isoniacida.
c) Individuos con ingesta diaria exagerada de alcohol.
Administración
Isoniacida 5mg/kg
de peso diariamente, en una sola toma, en adultos y niños,
sin exceder los 300 mg.
Forma de administración: autoadministrada.
Duración: 6 meses (en VIH/SIDA 12 meses).
Entrega: mensual, con registro en la tarjeta de tratamiento
antituberculoso.
Controles: mensuales, dirigidos a evaluar la adherencia
a la quimioprofilaxis o la aparición de manifestaciones
adversas.
Interrogar en forma dirigida sobre anorexia, náuseas,
vómitos, ictericia, coluria, dolor abdominal, fiebre,
rash cutáneo y parestesias. La presencia de alguno
de estos síntomas por más de tres días
debe ser motivo de suspensión de la droga y evaluación
médica.
CIRUGIA EN LA TBC
PULMONAR
En la época
anterior a la quimioterapia, la cirugía de la TBC
pulmonar alcanzó un alto grado de desarrollo y salvó
a muchos enfermos de la muerte. Esta cirugía consistía
generalmente en la resección de las áreas
comprometidas que, cuando eran muy extensas, debía
acompañarse de colapso quirúrgico de la pared
torácica (toracoplastía) para rellenar el
hueco que dejaba el pulmón resecado. Algunos enfermos
aún sobreviven con secuelas graves e insuficiencia
respiratoria crónica de grado variable.
En este momento,
la cirugía de la TBC pulmonar tiene indicaciones
muy restringidas y se reserva para el manejo de la hemoptisis
masiva y las infecciones secundarias graves de cavidades
preexistentes (abscesos pulmonares, aspergilomas). La cirugía
puede ser utilizada en casos de BK multirresistentes con
el propósito de disminuir la población bacilar.
También cabe mencionar la cirugía de la pleura
en casos de neumotórax secundarios o empiemas TBC.
Ocasionalmente se opera a pacientes sin diagnóstico
etiológico previo que resultan ser de origen tuberculoso
en el estudio histológico postoperatorio.
PROGRAMA NACIONAL DE
CONTROL DE LA TUBERCULOSIS (PCT)
Definición
El Programa de Control
de la Tuberculosis es un programa de salud pública
de alcance nacional descentralizado, cuyas normas y operaciones
técnicas se cumplen en todos los niveles de la estructura
del Sistema Nacional de Servicios de Salud del país
y en las Secretarías Regionales Ministeriales de
Salud. Su éxito depende fuertemente de la convicción
que exista a nivel político de la importancia del
problema de salud pública que significa la TBC de
manera que se otorguen y mantengan los recursos adecuados
que, medidos como costo por año de vida ganado, son
muy inferiores a los de otras enfermedades como el cáncer
o el SIDA.
Objetivo general
Reducir significativamente
el riesgo de infección, la morbilidad y mortalidad
por tuberculosis en Chile, hasta obtener su eliminación
como problema de salud pública.
Objetivos específicos
- Lograr coberturas de vacunación
BCG del 100% de los recién nacidos.
- Localizar y diagnosticar sobre
el 70% de la incidencia estimada de los casos pulmonares
bacilíferos a través de baciloscoía
y cultivo.
- Lograr 90% de curación
de los casos pulmonares confirmados bacteriológicamente
que ingresan a tratamiento con esquema primario.
- Efectuar estudio completo en
más del 90% de los contactos de casos pulmonares
confirmados bacteriológicamente y de los casos
de tuberculosis en cualquiera de sus formas, en menores
de 14 años.
- Mantener tendencia decreciente
de la incidencia de casos en todas las formas de tuberculosis,
con reducción anual del 7% o más, con el
fin de alcanzar la meta sanitaria en el plazo propuesto.
Meta sanitarias
El Ministerio de
Salud se ha propuesto alcanzar la meta de “"eliminación
avanzada"”, definida como morbilidad de 10 por
cien mil habitantes en el año 2008 - 2010, y la meta
de “eliminación como problema de salud pública”,
tasa de 5 por cien mil, en el año 2020.
Población
objetivo
Toda la población
es beneficiaria de las actividades del programa independientemente
de su condición previsional. Por ello sus acciones
están integradas en el Sistema Nacional de Servicios
de Salud y son gratuitas.
La mayoría
de las acciones contra el bacilo de Koch varían de
un país a otro según su realidad epidemiológica.
En países desarrollados, en que la tasa de infección
es muy baja, se puede intentar la identificación
de los individuos infectados, PPD positivos, para tratarlos
y así eliminar una eventual fuente de contagio. En
países con alta tasa de infección, en cambio,
los recursos y esfuerzos se deben concentrar en localizara
los individuos bacilíferos. En países de muy
bajo nivel de desarrollo y escasos medios puede ser más
productivo gastar los recursos en vacunación BCG
y en tratamiento, sin hacer pesquisa de las fuentes de contagio.
Para lograr una rápida disminución de la morbilidad,
mortalidad y riesgo de infección por tuberculosis,
en Chile se efectúa una serie de acciones coordinadas
y uniformes en todos los Servicios de Salud. Las principales
acciones del programa son:
a) Prevención: Vacunación
BCG al recién nacido.
b) Pesquisa de nuevos casos. Se efectúan 2 baciloscopías
a todos los "sintomáticos respiratorios" que consultan
en los Servicios de Salud o que están hospitalizados
en estas instituciones por cualquier motivo. Radiografía
de tórax a los sintomáticos mayores de 50
años.
c) Tratamiento. Debe efectuarse de acuerdo a las normas
entregadas por el Ministerio de Salud y supervisadas por
las centrales de tratamiento.
d) Rescate de inasistentes al tratamiento.
e) Estudio de contactos. Por ser un grupo con alto riesgo
de enfermar de TBC pulmonar, se examina a todos los contactos
de pacientes con TBC pulmonar comprobada bacteriológicamente
y a los contactos de niños con TBC en cualquier órgano.
A todos los contactos se les efectúa examen bacteriológico
de expectoración, si la tienen, y una radiografía
de tórax. Se trata a los contactos con bacteriología
positiva y/o lesiones radiográficas progresivas.
A los contactos menores de 15 años se efectúa,
además, un examen de PPD. Si éste resulta
negativo en ausencia de cicatriz BCG, se efectúa
quimioprofilaxis con HIN y luego se vacuna con BCG. A los
contactos menores de 4 años con PPD positivo, sin
cicatriz BCG, se los considera recientemente infectados
y, por lo tanto, se indica tratamiento. En el cumplimiento
de estas normas es fundamental el trabajo en equipo, en
el que adquiere gran importancia el personal de enfermería,
que está a cargo de prácticamente todas las
acciones. El médico, en general, cumple la labor
de control clínico, tratamiento de las enfermedades
asociadas y de los eventuales efectos secundarios del tratamiento.
El trabajo del personal de enfermería debe ser supervisado
por un equipo constituido principalmente por un médico
y una enfermera encargados del plan a nivel regional.
| A pesar de los progresos, la
TBC sigue siendo en Chile un problema real que enferma
y mata personas a pesar de ser una afección diagnosticable
y altamente curable .Su inclusión en el diagnóstico
diferencial debe ser sistemática, especialmente
en localidades de alta incidencia y en grupos de alto
riesgos. Hecho el diagnóstico el paciente debe
ser referido a los los centros de tratamiento del Programa
Nacional y en ningún caso debe intentarse variantes
personales de los sistemas normados. |
VINCULO PROGRAMÁTICO
- Programa Nacional de Control de la Tuberculosis : Manual de procedimientos
http://www.redsalud.gov.cl/portal/url/item/803048171acc60f8e04001011f0148e2.pdf
|
|
|
