|
Hace cien años el cáncer pulmonar
era una rareza pero actualmente es una de las causas más
comunes de muerte por cáncer en hombres y mujeres en el mundo
desarrollado, y en un futuro próximo lo será en el
mundo entero. Alrededor del 90% de los cánceres pulmonares
son causados por el tabaco y solamente un pequeño porcentaje
por otros inhalantes ambientales como radón y aldehídos.
El cáncer pulmonar no tiene signos ni síntomas propios
que permitan su detección en etapas precoces, y por esto
la mayoría de los pacientes se diagnostican en etapas avanzadas
de la enfermedad.
En la última década han ocurrido cambios importantes
en la estrategia diagnóstica y en el tratamiento del cáncer
pulmonar, pero la prevención y el diagnóstico precoz
siguen siendo la clave pendiente para un manejo exitoso. La investigación
de nuevos marcadores biológicos y genéticos probablemente
permitirá un tratamiento más adecuado de la enfermedad
en el futuro y la introducción de la tomografía con
emisión de positrones (PET) ha permitido una etapificación
más precisa y menos invasiva. Las nuevas modalidades terapéuticas,
con agentes quimioterápicos más eficaces y con menos
efectos secundarios, sumadas a nuevas técnicas de radioterapia
han mejorado la sobrevida y la calidad de vida en pacientes con
enfermedad localmente avanzada. Sin embargo, aun con estos avances
la sobrevida a 5 años apenas ha mejorado y se mantiene entre
5 y 15%.
El primer artículo científico que confirmó
la sospecha que el cáncer pulmonar se asociaba al hábito
tabáquico se publicó en 1950 y posteriormente, en
1964, el gobierno de Estados Unidos publicó un informe basado
en la literatura médica acumulada en el que ratifica
este riesgo y establece la necesidad de realizar esfuerzos para
evitar el inicio y promover la suspensión del consumo de
tabaco. Después de estas publicaciones, la incidencia de
tabaquismo ha disminuido en los países desarrollados, con
la consecuente disminución del cáncer pulmonar alrededor
de veinte años después.
El cáncer bronquial es una de las neoplasias
malignas de mayor trascendencia por su creciente incidencia y alta
mortalidad, con el agravante de ser una enfermedad en gran medida
evitable mediante el control del tabaquismo.De acuerdo con proyecciones
de la Organización Mundial de la Salud, el cáncer
bronquial y el SIDA serán las enfermedades más comunes
del siglo XXI. Ambas se asocian a estilos de vida susceptibles de
modificación y presentan curvas de sobrevida muy semejantes.
Al momento del diagnóstico, el 50% de los
pacientes son inoperables y, de aquellos que lo son, sólo
en la mitad es posible realizar una cirugía con posibilidad
curativa, es decir, apenas un 25% del grupo original. Es una enfermedad
agresiva que produce metástasis desde muy temprano, determinando
que la sobrevida a un año sea inferior al 20% y que la sobrevida
promedio a 5 años, incluidas todas las etapas de la enfermedad,
no supere el 15 %.
Todos estos antecedentes obligan a poner énfasis
en su prevención y diagnóstico precoz, ya que el pronóstico
mejora si la enfermedad se detecta antes de que se haya diseminado.
Sin embargo, los esfuerzos para implementar programas de detección
precoz mediante pesquisa masiva con radiografías de tórax
y citología seriada de expectoración anual o semestral,
no han reducido la mortalidad por cáncer bronquial . Los
estudios con TAC de tórax han mostrado mejores resultados
y en la actualidad se usa en protocolos de pesquisa en población
de alto riesgo, porque su aplicabilidad a nivel poblacional general
es limitada. Por estas razones los esfuerzos deben centrarse en
su prevención mediante el control del hábito tabáquico.
EPIDEMIOLOGIA Y ETIOLOGIA
A nivel mundial, el cáncer pulmonar es
la neoplasia maligna mas frecuente y anualmente ocurren más
de 1.000.000 de muertes por cáncer pulmonar. En Estados Unidos
y la mayoría de los países europeos es la primera
causa de muerte por cáncer en hombres, pero su incidencia
no ha seguido en aumento; en cambio, en las mujeres, la incidencia
aún sigue aumentando, sobrepasando el cáncer de mama.
La tasa actual de mortalidad general por cáncer pulmonar
en Estados Unidos es menor de 5 por 100.000 habitantes. Desafortunadamente
en los países en desarrollo la incidencia de cáncer
pulmonar sigue en aumento.
En Chile, actualmente el cáncer pulmonar es el tercero en
frecuencia en hombres y el cuarto en mujeres y la tasa de mortalidad
ha ido en aumento en las últimas décadas: era de 10,2
por 100.000 habitantes en 1988, 11,3 en 1994, y 13,8 en 2004. Esta
última cifra significa que cada día mueren alrededor
de 6 personas por esta causa. Sigue siendo más frecuente
en hombres que en mujeres, pero esta diferencia se ha ido estrechando
en los últimos años por un incremento acelerado en
el consumo de cigarrillos en las mujeres.
Si bien este cáncer se presenta con mayor frecuencia en sujetos
mayores de 45 años de edad, se ha observado una creciente
incidencia en personas jóvenes, presentándose actualmente
un 1% de casos en menores de 30 años.
La causa más importante de cáncer pulmonar es la exposición
al humo de tabaco, ya sea activa o pasivamente.
| TABLA
37-1
INCIDENCIA DE CANCER BRONQUIAL
SEGUN HABITO TABAQUICO |
| Antecedentes tabáquicos |
Incidencia por 100.000
|
| No fumadores |
3,4 |
| 10 a 20 cigarrillos/día |
60 |
| 21 a 40 cigarrillos/día |
217 |
El humo de cigarrillo es responsable del 85-90%
de todos los cánceres pulmonares y laríngeos, siendo
además uno de los principales factores causales de cáncer
oral, esofágico y vesical. En el humo del tabaco se han aislado
sustancias cancerígenas como benzopirenos, nitrosaminas y
antracenos, las que actúan tanto induciendo cambios en los
genes que originan la proliferación tumoral, como promueven
su posterior crecimiento y diseminación. Existe una clara
relación entre el número total de cigarrillos consumidos
y la incidencia de cáncer, por lo que el riesgo es mayor
en los que se inician en el hábito a edad temprana (Tabla
37-1).
La inhalación pasiva de humo de cigarrillo
también es de riesgo: la incidencia de cáncer bronquial
en fumadores pasivos es de 1,2 a 1,5 veces mayor que la de los no
expuestos. Se calcula que el 40% de los cánceres en no fumadores
se debe a inhalación pasiva.
El riesgo para el ex fumador disminuye a la mitad
a los 5 años de abstención y a una cuarta parte a
los 10 años, persistiendo siempre algo más elevado
que el resto de la población. Por ello, el método
más efectivo para reducir la incidencia de cáncer
bronquial es evitar que los no fumadores adquieran la adicción
y procurar que los fumadores la abandonen lo más tempranamente
posible.
No hay evidencias epidemiológicas que establezcan
que la contaminación atmosférica sea un factor importante
en la génesis del cáncer bronquial; sin embargo, se
ha sugerido una acción sinérgica entre algunas partículas
y el hábito de fumar. Hay también otros inhalantes,
algunos determinados por riesgos ocupacionales, que favorecen el
desarrollo de cáncer bronquial, tales como exposición
a asbesto, radón, aldehídos, arsénico y cromo.
Por último, existen evidencias que factores
genéticos facilitan el desarrollo de estas neoplasias. Los
parientes en primer grado de un enfermo con cáncer pulmonar
tienen un riesgo 2,4 veces mayor de desarrollar neoplasias. También
se ha constatado una predisposición genética al desarrollo
de una segunda neoplasia en pacientes tratados por cáncer
pulmonar.
Los cambios moleculares que caracterizan el cáncer
pulmonar son complejos, resultando en una falta de regulación
de las vías que controlan el crecimiento celular normal,
la diferenciación celular y la apoptosis. Varias de estas
vías incluyen protoncogenes y genes supresores de tumores
que ya están caracterizados y que se sabe están mutados
o que tienen un patrón de expresión anormal.
ANATOMIA PATOLOGICA
La mayor parte de los tumores bronquiales se originan
en las células del epitelio bronquial. El desarrollo tumoral
toma varios años, pasando por etapas de metaplasia, atipias
celulares y carcinoma in situ, hasta llegar finalmente a tumor invasivo.
La clasificación actual de la Organización
Mundial de la Salud (OMS) sigue distinguiendo cuatro tipos
principales de cáncer pulmonar: carcinoma epidermoide o pavimentoso,
adenocarcinoma, carcinoma indiferenciado de células grandes
y carcinoma indiferenciado de células pequeñas. Estos
constituyen el 95% de los cánceres pulmonares, pero existen
otros tipos de baja incidencia y se diferencia algunos subgrupos
que son de resorte del especialista. Un porcentaje no despreciable
de cánceres pulmonares se caracteriza por una mezcla de tipos
histológicos dentro de la misma masa tumoral, los que desde
el punto de vista clínico deben tratarse de acuerdo al tipo
más agresivo.
En la práctica clínica es conveniente
distinguir dos grupos de acuerdo a diferencias en comportamiento
biológico y respuesta a tratamiento:
a) carcinoma de células pequeñas
(CCP).
b) carcinoma de no células pequeñas (CNCP).
La frecuencia de los distintos tipos histológicos
varía según el grupo analizado, ya que los más
malignos son más numerosos si se trata de series basadas
en autopsias, mientras que predominan los más operables en
estudios efectuados en piezas quirúrgicas. En nuestro hospital,
en una revisión de los últimos diez años, la
frecuencia relativa de los distintos tipos histológicos en
muestras de biopsias endoscópicas, por punción transtorácica
y quirúrgicas son las siguientes:
33% epidermoides
o escamosos
32% adenocarcinoma
13% carcinoma indiferenciado
de células pequeñas
5%carcinoma
indiferenciado de células grandes
En revisiones de autopsias, en cambio, la
distribución es diferente en relación a la diferente
letalidad de los tipos histológicos:
16%
de escamosos
21% de células
pequeñas
34% de adenocarcinomas
26% de células
grandes
Sobre la base del tiempo medio de duplicación
de la masa tumoral, se ha calculado que para llegar desde una célula
neoplásica a un tumor de 2 cm de diámetro, un cáncer
anaplástico necesita 7 años, un epidermoide 9 y un
adenocarcinoma 20. Para cualquier tipo histológico, la etapa
clínica corresponde a menos de la cuarta parte de la vida
del tumor.
Los carcinomas escamosos y de células pequeñas
predominan en bronquios gruesos, dando origen a un tumor hiliar,
mientras que los adenocarcinomas y, en menor grado, los indiferenciados
de células grandes, se originan en bronquios menores, presentándose
como tumores periféricos. Si bien las manifestaciones clínicas
son comunes a los cuatro tipos histológicos de cáncer
pulmonar, por la localización anatómica señalada
el carcinoma epidermoide tiende a presentar síntomas y complicaciones
por obstrucción bronquial más precozmente.
El cáncer bronquial tiene, en general, una
fuerte tendencia a la diseminación, que es máxima
en el de células pequeñas. Prácticamente todos
los pacientes con este tipo histológico presentan metástasis
al momento del diagnóstico, lo que explica que la mayoría
de estos casos no tenga solución quirúrgica. Este
tipo histológico también es el que presenta con mayor
frecuencia manifestaciones paraneoplásicas.
MANIFESTACIONES CLINICAS
Las manifestaciones clínicas son muy variadas
e inespecíficas, siendo con frecuencia difíciles de
distinguir de los síntomas propios del fumador crónico.
Por esto no es raro que el cáncer pulmonar se manifieste
primero por sus metástasis. En un 10% de los pacientes es
asintomático, constituyendo un hallazgo en una radiografía
de tórax solicitada por otros motivos.
Los síntomas y signos del cáncer
bronquial son muy numerosos, y derivan de:
Efectos locales en el pulmón:
tanto directos como por complicaciones, causadas principalmente
por la obstrucción bronquial (neumonitis obstructiva y
atelectasias).
Efectos de invasión de estructuras
vecinas: ganglios hiliares, órganos mediastínicos,
pleura, pared torácica, nervios, pericardio, etc.
Metástasis hematógenas:
especialmente en cerebro, hígado, huesos y suprarrenales.
Síndromes paraneoplásicos:
no se relacionan directamente con efecto físicos del tumor
y se deberían a péptidos hormonosímiles y
a mecanismos inmunológicos.
El cuadro clínico del paciente puede iniciarse
en cualquiera de estos niveles, pudiendo algunos síntomas
y signos, alejados y aparentemente ajenos, preceder en meses a los
locales. En general, los síntomas locales son más
frecuentes en los pacientes con CNCP y, en cambio, las manifestaciones
sistémicas (baja de peso, anorexia, fatigabilidad, fiebre),
metastásicas y paraneoplásicas lo son en los con CCP.
Manifestaciones locales
Tos: es el síntoma más frecuente
y se presenta en el 75% de los casos. Es generalmente poco productiva
y se confunde con la tos habitual del fumador. En estos pacientes,
todo cambio de carácter de la tos debe ser motivo de sospecha
e investigación. Es más frecuente en tumores hiliares
y en la forma bronquíolo-alveolar del adenocarcinoma, en
la que la expectoración mucosa puede ser, en algunos casos,
muy abundante.
Expectoración hemoptoica: en algunas
series se describe hasta en un 50% de los pacientes con cáncer
bronquial. Por esta razón su presencia en pacientes mayores
de 30 años, sobre todo fumadores, obliga a un estudio exhaustivo
que demuestre o descarte un cáncer. Generalmente es de poca
cuantía y de varios días de duración.
Complicaciones de la obstrucción bronquial:
pueden deberse directamente al tumor, a adenopatías metastásicas
o a inflamación y secreciones por infección agregada.
Sus consecuencias pueden ser atelectasias, neumonías, o una
combinación de ambas (neumonitis obstructiva). Cualquiera
de estas manifestaciones exige que, en los pacientes con riesgo
de cáncer, se extremen los exámenes destinados a descartar
la existencia de un tumor preexistente.
Disnea: se observa en entre un 30 a 60%
de los pacientes con cáncer bronquial. La aparición
de este síntoma o su agravación, si ya existía
por efecto del tabaquismo, puede ser consecuencia de múltiples
mecanismos: obstrucción de un bronquio grueso, atelectasias,
neumonías, derrame pleural, parálisis diafragmática
por compromiso frénico, etc.
Manifestaciones por compromiso de estructuras vecinas
Dolor: puede deberse a compromiso pleural,
óseo o de nervios intercostales. Si se comprime el plexo
braquial, el paciente puede consultar por dolor en el hombro y brazo
(síndrome de Pancoast).
Derrame pleural: puede deberse a neumonías,
estasia linfático por adenopatías mediastínicas
o a invasión tumoral de las pleuras.
Disfonía o voz bitonal: producida
por compromiso del nervio recurrente laríngeo.
Síndrome de Claude Bernard-Horner:
constituido por enoftalmo, ptosis palpebral y miosis, se debe a
la compresión de la cadena simpática cervical y se
observa en los tumores del vértice pulmonar. Puede encontrarse
junto con el síndrome de Pancoast.
Parálisis diafragmática:
debida al compromiso del nervio frénico.
Síndrome de vena cava superior:
se debe a compresión o invasión de este vaso.
Pericarditis y derrame pericárdico:
causados por irritación o invasión tumoral.
Disfagia: puede originarse en compresión
o invasión del esófago.
Manifestaciones metastásicas
Las metástasis son especialmente frecuentes
en el adenocarcinoma y en el carcinoma de células pequeñas.
Las manifestaciones clínicas de la enfermedad metastásicas
varían según el órgano comprometido. Los que
con mayor frecuencia son asiento de metástasis en el cáncer
bronquial son los huesos, cerebro, hígado y suprarrenales.
La alta frecuencia de metástasis cerebrales hace que la radiografía
o TAC de tórax forme parte obligada del estudio de todo tumor
encefálico.
Síndromes paraneoplásicos
Los síndromes paraneoplásicos son
muy numerosos y variados. Ocurren hasta en un 10 % de los pacientes,
pudiendo en ocasiones ser la primera manifestación de un
tumor. Se los clasifica en:
ENDOCRINOS
Los cánceres bronquiales producen con alguna
frecuencia sustancias con efecto hormonal. Entre ellas se han descrito
sustancias con acción similar a las hormonas ACTH, antidiurética,
melanoestimulante, de crecimiento, paratiroidea, gonadotropinas,
calcitonina, etc. Si bien cada tipo de alteración está
ligada preferentemente a un determinado tipo histológico,
las excepciones y superposiciones son numerosas. Algunos tumores
producen, además, sustancias hormonosímiles que favorecen
el proceso tumoral mismo, como es el caso de la bombesina secretada
por tumores de células pequeñas. Por lo expuesto se
comprende que las manifestaciones paraneoplásicas pueden
ser muy variadas. Entre ellas destacan:
Secreción ectópica de ACTH:
se produce especialmente en carcinomas de células pequeñas,
carcinoides y timomas malignos. Esta hormona ectópica puede
provocar fatigabilidad muscular, elevación de 17 hidroxicorticoides,
hipokalemia, e incluso un síndrome de Cushing .
Secreción inapropiada de hormona antidiurética:
también se asocia predominantemente al carcinoma de células
pequeñas. En la mayoría de los pacientes se manifiesta
como hiponatremia asintomática debida a la retención
de agua, que puede acentuarse con la quimioterapia, por destrucción
de células neoplásicas y mayor liberación de
péptidos con acción antidiurética.
Hipercalcemia: Si bien en un 85 a 90% de
los pacientes con cáncer bronquial la hipercalcemia es secundaria
a metástasis óseas, en ausencia de metástasis
puede deberse a la secreción de sustancias paratohormona-símiles
o a prostaglandinas ectópicas por carcinomas pavimentosos
y, en menor proporción, por carcinoma de células grandes.
La mayoría de estas alteraciones presentan
escasos síntomas, pero en ocasiones su intensidad puede necesitar
de tratamiento sintomático.
NO ENDOCRINOS
Los más importantes son:
Dedo hipocrático: se observa especialmente
en el adenocarcinoma, en el cual se describe en alrededor de un
12% de los casos. El dedo hipocrático es muy sugerente de
cáncer cuando se desarrolla en forma rápida. Puede
asociarse a osteoartropatía hipertrófica y simular
cuadros "reumáticos".
Compromiso del estado general: se manifiesta
como astenia, anorexia y baja de peso. Es frecuente en casos avanzados,
su ausencia nunca debe constituir un argumento en contra de un cáncer
bronquial.
Vasculares y hematológicos: la tromboflebitis
migratoria es muy sugerente de cáncer y se presenta, sin
otros factores predisponentes, en varios sitios a la vez. También
pueden presentarse endocarditis no bacterianas con embolización
arterial, coagulación intravascular diseminada, púrpura
trombocitopénico, anemia hemolítica, etc.
Neurológicos: neuropatías
periféricas, miopatías, compromiso cerebeloso, etc.
Dermatológicos: dermatomiositis,
acantosis nigricans (hiperqueratosis pigmentada de pliegues flexurales),
hiperqueratosis palmoplantar.
En suma, el cáncer bronquial es una enfermedad
de presentación extremadamente variada, que va desde un hallazgo
radiográfico en un paciente asintomático hasta un
cuadro general, sin aparente relación con el tórax,
pasando por el síndrome respiratorio altamente sospechoso.
Esta multiplicidad de formas de presentación obliga a pensar
en cáncer bronquial ante cualquier manifestación compatible
en un fumador. La omisión de un estudio diagnóstico
dirigido en estos últimos es un error grave y deplorable.
FORMAS ESPECIALES DE CANCER
Carcinoma bronquíolo-alveolar
Es una variante del adenocarcinoma papilar que se caracteriza por
crecer tapizando el interior de los alvéolos, lo que radiológicamente
puede simular una neumonía con broncograma aéreo.
Suele presentarse como una lesión localizada de lenta progresión
o propagarse al resto de los pulmones en forma irregular, dando
la impresión de una diseminación canalicular o de
un proceso multifocal. En algunos raros casos produce abundante
secreción mucosa.
En general da metástasis en forma tardía,
razón por la cual la exéresis quirúrgica de
las formas localizadas tiene mejor sobrevida que la de otros tipos
histológicos.
Tumor de Pancoast
Se trata de una localización en el vértice
pulmonar, o sulcus superior (Figura 37-1), que da origen a síntomas
derivados de la invasión y/o compresión de plexo braquial
(trastornos sensitivos y motores de la extremidad superior), costillas
superiores (dolor local), filetes simpáticos (síndrome
de Claude Bernard-Horner). El tumor puede ser de cualquier tipo
histológico, siendo más corriente el escamoso.
El tratamiento de elección depende de la extensión
del tumor y se recurre a diversas combinaciones
de cirugía, quimio y radioterapia.

Figura 37-1. Tumor de Pancoast.
La masa tumoral se encuentra en el vértice del pulmón
izquierdo. Cuando el tumor es pequeño, puede ser
muy difícil de apreciar, debido a la sobreposición
de la primera costilla y de la clavícula. En estos
casos, los huesos pueden desproyectarse con una radiografía
efectuada en hiperlordosis o mediante una TAC.
PROCESO DIAGNOSTICO
Para el diagnóstico del cáncer bronquial
son fundamentales una actitud de permanente alerta por parte del
médico y la decisión de realizar una búsqueda
metódica y exhaustiva ante todo paciente con riesgo o con
síntomas sospechosos.
Planteada la sospecha por los datos de anamnesis
y examen físico, el estudio se encamina a:
Precisar la morfología de las lesiones,
demostrando la existencia de imágenes compatibles con la
hipótesis de cáncer.
Determinar la histología del tumor.
Para esto es necesario obtener muestras para examen microscópico,
siendo en primer término indispensable determinar si es
un tumor de células pequeñas o de células
no pequeñas para dirigir el
estudio y la conducta terapéutica.
Etapificación del cáncer.
Consiste en determinar el grado de extensión local del
tumor y definir si se ha extendido a los ganglios hiliares o mediastínicos,
a estructuras vecinas o a distancia.
El rol fundamental del primer
médico que ve al enfermo es sospechar oportunamente
el cáncer y solicitar el estudio morfológico. Las
etapas de confirmación histológica y etapificación
y tratamiento corresponden un equipo
multidisciplinario de especialistas.
EXAMENES AUXILIARES
Radiografía de tórax :en proyecciones
posteroanterior y lateral.
En ella puede observarse:
a) Imágenes directas del tumor en el parénquima
pulmonar con masas de tamaño variable, únicas o
múltiples (Figura 37-2).
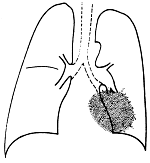
Figura 37-2. Cáncer del lóbulo
inferior izquierdo: se ve una masa parcialmente oculta detrás
del corazón, ya que no borra su silueta. El borde
no es regular y se observan algunas espículas, altamente
sugerentes de la etiología neoplásica.
b) Masas hiliares o prominencia hiliar sin masa
pulmonar clara (Figura 37-3).

Figura 37-3. Masa hiliar: el hilio
derecho se ve de mayor volumen, pudiendo apreciarse la sobreposición
de una masa redondeada que puede corresponder
a adenopatías o a tumor central.
c) Imágenes derivadas del fenómeno
de obstrucción bronquial: neumonitis obstructiva, absceso
pulmonar, atelectasia, etc.
d) Imágenes inespecíficas derivadas
de complicaciones del tumor, como derrame pleural y parálisis
diafragmática.
e) Imágenes de adenopatías mediastínicas
o ensanchamiento mediastínico.
f) Ausencia de imágenes patológicas:
una radiografía normal de ninguna manera significa el fin
del estudio en un paciente de alto riesgo cuyos síntomas
son compatibles con una neoplasia pulmonar. Los tumores pequeños,
sin complicaciones, pueden ser enmascarados por las estructuras
normales del tórax.
Broncoscopía: establecida la sospecha
diagnóstica de cáncer bronquial mediante la historia,
examen físico o radiografía de tórax, es necesario
corroborar histológicamente, el diagnóstico y determinar
su tipo. Esto se logra en la mayoría de los casos con una
fibrobroncoscopia especialmente en los pacientes
que presentan lesiones centrales o hiliares sugeridas por atelectasias
lobulares o segmentarias, neumonitis recurrente o de resolución
prolongada, signos clínicos como disfonía, o hemoptisis,
o citología positiva de expectoración.
El rendimiento diagnóstico de la broncoscopía
con las lesiones visibles, junto a los exámenes citológico
e histológico de las muestras obtenidas, es cercano al 90%.
En el caso de tumores de diámetro igual o superior a 2 cm
en la radiografía y no visibles endoscópicamente,
se puede intentar la obtención de muestras por vía
transbronquial bajo visión radioscópica, con rendimientos
cercanos al 60%. Esta sensibilidad disminuye en nódulos o
masas de menor tamaño, que es preferible abordar por vía
percutánea siempre que sean periféricas y tengan 10
o más mm de diámetro.
Además, la endoscopía es necesaria
para la etapificación del cáncer bronquial, ya que
permite demostrar signos que determinarán
la operabilidad, como compromiso tumoral de tráquea,
carina, bronquios fuentes a menos de 2 cm de la carina principal,
otros tumores bronquiales simultáneos
o parálisis de cuerda vocal. Se pueden utiliza agujas
especiales, como la de Wang, que permiten obtener muestras para
estudio citológico e histológico de masas mediastínicas
por punción transbronquial.
Citología de expectoración:
forma parte del estudio endoscópico, cuya sensibilidad aumenta
en forma importante. Si las condiciones del paciente no permiten
un examen endoscópico, puede efectuarse un estudio citológico
de muestras seriadas de expectoración. Su rendimiento está
íntimamente ligado a la técnica de toma de muestra,
experiencia del citólogo observador y ubicación del
tumor. Series extranjeras comunican rendimientos de hasta 90% en
lesiones centrales. Se recomienda el análisis de al menos
3 muestras de expectoración seriadas, fijadas en alcohol
al 50% tan pronto sean emitidas.
Punción transtorácica: las
masas o nódulos periféricos de 10 mm o más,
no visibles endoscópicamente, pueden ser puncionadas con
aguja fina bajo control radiológico. El material aspirado
se somete a examen citológico y, en ocasiones, se puede obtener
trozos para histología. .Su
especificidad es cercana al 95% pero su sensibilidad
es mucho menor , por lo cual un resultado negativo no descarta una
neoplasia maligna . El procedimiento es generalmente bien
tolerado. En pacientes con función pulmonar límite,
debe tenerse presente que presenta, aunque bajo, un riesgo de neumotórax.
Por este motivo está contraindicada si existen bulas en el
trayecto que debe seguir la aguja, como también si existe
la posibilidad de un quiste hidatídico.
Tomografía axial computarizada
(TAC): es el examen de elección para definir la morfología
del tumos y buscar ganglios en el mediastino, donde supera
netamente a la radiografía simple . Su sensibilidad para
determinar el compromiso del mediastino es en globo alrededor de
60% y la especificidad de un 80%. La información proporcionada
por una TAC permite decidir la obtención de muestras histológicas
a través de mediastinoscopía. Toda TAC de tórax
efectuada en pacientes con el diagnóstico de cáncer
bronquial debería incluir las glándulas suprarrenales,
por ser éste un sitio frecuente de metástasis. La
resonancia nuclear magnética de tórax no es más
sensible ni más específica que la TAC para el estudio
de la extensión a mediastino, por lo que esta última
continúa siendo el procedimiento de elección con este
propósito.
Tomografía con emisión de
positrones (PET): es una técnica de imágenes
no invasiva que utiliza isótopos emisores de positrones unidos
a flúorodeoxiglucosa (FDG), lo que permite detectar el metabolismo
glucídico aumentado de las células tumorales. Este
examen es de gran utilidad en el diagnóstico y etapificación
del cáncer pulmonar, ya que permite obtener información
de la actividad metabólica tisular en todo el cuerpo. Su
sensibilidad para el estudio del mediastino es alrededor de 85%
y la especificidad de un 89%, y si se combina con TAC, se obtiene
mejor sensibilidad y especificidad. Su limitación es el alto
costo y limitada disponibilidad.
Mediastinoscopía: consiste en la
introducción de un mediastinoscopio a través de una
pequeña incisión en la pared torácica, que
permite ver y tomar muestras del mediastino. Su principal indicación
es la evaluación de los ganglios hiliares y mediastínicos
para la etapificación del tumor. Su rendimiento mejora cuando
las áreas con anormalidades morfológicas son previamente
localizadas por TAC.
Toracotomía: si todos los exámenes anteriores
son incapaces de precisar el diagnóstico de una masa o nódulo
y no hay signos de diseminación ni contraindicaciones de operabilidad,
puede recurrirse a la toracotomía exploradora, con biopsia
contemporánea. Si resulta positiva para neoplasia, se prosigue
con la exéresis del lóbulo afectado, y si no, se hace
una resección económica.
ESTUDIO DE DISEMINACION
Es un área que está en variación
por los nuevos desarrollos tecnológicos y que depende de
las disponibilidades locales.
Tomografía axial computarizada (TAC)
de cerebro: un 10% de los pacientes con cáncer bronquial
se presentan con metástasis cerebrales, las cuales deben
investigarse mediante una TAC, cuya sensibilidad en esta localización
es superior al 90%.
Resonancia nuclear magnética:
se ha demostrado su superioridad para detectar metástasis
cerebrales, que pueden estar presentes aun en casos con examen neurológico
normal.
Cintigrafía ósea: aproximadamente
un 20% de los pacientes con cáncer bronquial son inoperables
por presentar metástasis óseas. El mejor método
para su detección es la cintigrafía ósea, basada
en la capitación de un indicador radioactivo por el tejido
neoplásico. Es un examen altamente sensible, aunque poco
específico, ya que también puede alterarse en enfermedades
esqueléticas benignas, tales como secuelas de fracturas,
lesiones degenerativas, tumores benignos, etc. Por ello, el hallazgo
de imágenes cintigráficas únicas, escasas o
de distribución o forma no característica, es de difícil
interpretación y debe complementarse con radiografías
dirigidas a las zonas de captación para definir las características
de las lesiones. El hallazgo de imágenes múltiples,
en cambio, permite establecer el diagnóstico de metástasis
óseas con mayor certeza.
Ecotomografía hepática: otro
sitio frecuente de metástasis es el hígado, que debe
investigarse mediante una ecotomografía o TAC.
Biopsias de otros órganos: son útiles
en circunstancias en que se sospeche metástasis de un cáncer
bronquial. Pueden efectuarse biopsias de ganglios palpables, de
médula ósea en pacientes portadores de carcinoma de
células pequeñas, que en un 25% presentan compromiso
medular, y punciones con aguja fina de suprarrenales, guiadas por
TAC.
TRATAMIENTO
A pesar de los avances en las técnicas quirúrgicas
y en la radioterapia, y pese a la introducción de múltiples
agentes quimioterápicos en las últimas décadas,
el resultado a largo plazo del tratamiento del cáncer ha
mejorado poco, ya que la supervivencia global a 5 años continúa
siendo de alrededor de un 13%. Si sólo se considera los cánceres
diagnosticados en etapas precoces, las sobrevidas alcanzan a 60-80%,
lo que demuestra que el mal resultado global se debe a que al momento
del diagnóstico la mayoría de los cánceres
ya han sobrepasado la etapa local y se encuentran diseminados.
Aunque existen casos anecdóticos de curación
espontánea, debe considerarse que la letalidad de la enfermedad
sin tratamiento es de 100%, de manera que rescatar definitivamente
aunque sólo sea un 13% de los enfermos, y prolongar la sobrevida
en otros, son razones suficientes para que se haga el esfuerzo terapéutico
máximo que corresponda en cada caso.
La elección de la conducta terapéutica
es compleja por diversas razones:
a) No existe ningún tipo de terapia cuya
eficacia sea absoluta y de aplicación universal.
b) Existen variables dependientes del cáncer
que condicionan la eficacia de los diferentes tratamientos: masa
tumoral, extensión, tipo histológico, localización,
etc.
c) Hay condiciones del paciente que determinan
el efecto y la aplicabilidad de las diferentes terapias: función
pulmonar, estado general, morbilidad concomitante, tolerancia
a drogas antitumorales, etc.
Etapificación
De los factores mencionados, la extensión
del tumor es el más difícil de objetivar, demandando
un estudio metódico y complejo. La escala más usada
para resumir sus resultados es la TNM, que combina información
sobre el tamaño del tumor (T), extensión regional
a los ganglios o nódulos linfáticos (N), y su extensión
a distancia o metástasis (M). Con estos datos se clasifica
el cáncer en 4 etapas que, básicamente, distinguen
si hay:
a) compromiso sólo del parénquima
pulmonar (etapa I)
b) extensión a los ganglios hiliares ipsilaterales
(etapa II)
c) extensión a ganglios mediastínicos
y órganos vecinos (etapa III)
d) extensión a distancia (etapa IV)
Esta nomenclatura es útil para decidir el
tratamiento, para comunicar y comparar información y para
establecer un pronóstico. Así por ejemplo, la sobrevida
a 5 años de un tumor no células pequeñas que
se detecta en etapa I es de 60-80%, en etapa II de 40-55%, en etapa
III de 3-6%,y en etapa IV de 1,3%.
Este proceso de etapificación exige algunos
exámenes invasivos o de alto costo, cuyos resultados pueden
ser de difícil interpretación, de manera que su indicación
y la consecuente toma de decisiones necesita del trabajo de un equipo
formado por el médico tratante y diversos especialistas.
Tipo histológico y tratamiento
Antes de decidir una conducta terapéutica,
es indispensable contar con un diagnóstico histológico.
Esto se debe a que los tumores de células no pequeñas
pueden ser resecados con buen éxito en casos de enfermedad
localizada, pero responden escasamente a quimioterapia, mientras
que los de células pequeñas presentan casi siempre
metástasis en el momento del diagnóstico y responden
en algún grado a quimioterapia, por lo que su tratamiento
debe ser básicamente sistémico.Por
la frecuencia con que presentan metástasis cerebrales la
aplicación de radioterapia cerebral profiláctica mejora
la calidad y posibilidad de sobrevida.
Tratamiento quirúrgico
La cirugía es el tratamiento de elección
en el cáncer pulmonar no células pequeñas.
Antes de tomar la decisión quirúrgica, debe evaluarse
si el paciente es operable y si el tumor es resecable y evaluar
los riesgos y la eventual utilidad de la intervención propuesta.
Clásicamente se indica cirugía en los pacientes en
etapa I, II y III A, que representan una cuarta parte de los enfermos
al momento del diagnóstico, y en algunos pacientes seleccionados
en etapa III B. Además pueden existir otros factores que,
aun en estas fases, hacen que el enfermo sea inoperable:
Función respiratoria en límites
incompatibles con resección pulmonar.
En todo paciente candidato a cirugía debe efectuarse una
espirometría y una determinación de gases arteriales.
La presencia de hipercarbia constituye una contraindicación
quirúrgica absoluta. La hipoxemia, en cambio, debe interpretarse
en términos de su patogenia en el caso individual, ya que
la cirugía puede extirpar precisamente el área causante
de cortocircuitos. En cuanto a los valores espirométricos,
si la capacidad vital forzada es superior al 40% del valor teórico,
y el VEF1 es mayor a 2 L, se considera que el paciente sería
capaz de tolerar hasta una neumonectomía, y no ha bajado
de 1 L sería capaz de tolerar una lobectomía. Si el
VEF1 es igual o inferior a 1 L generalmente se considera que el
paciente no tolera una resección. La capacidad de difusión
de monóxido de carbono (DLCO) también es útil,
ya que los pacientes que tienen < 60% del valor teórico
tienen mayor mortalidad, y los pacientes con DLCO < 80% del valor
teórico tienen 2-3 veces más complicaciones.
Malas condiciones generales. En la evaluación
de las condiciones generales del paciente importan más las
reservas biológicas que la edad cronológica. Así,
deben considerarse las funciones cardíaca, hepática
y renal, nutrición, etc. Obviamente, la insuficiencia cardíaca
grave, caquexia avanzada, arterioesclerosis generalizada, etc. constituyen
contraindicaciones quirúrgicas.
Es importante medir la capacidad global del sujeto
para desempeñar las actividades de la vida diaria, evaluación
que refleja las condiciones generales del paciente y el impacto
del cáncer en el organismo. Para ello se usan escalas como
el “performance status” del ECOG (Eastern Cooperative
Oncology Group) y la escala de Karnofsky, que tienen muy buena correlación
con la extensión de la enfermedad y con las probabilidades
de sobrevida (Tabla 37-2).
| TABLA
37-2
ESCALA DE KARNOFSKY |
| PUNTAJE |
CRITERIO |
| 100 |
Paciente asintomático, sin evidencias de enfermedad |
| 90 |
Puede desempeñar actividades
normales, presenta síntomas o signos leves de enfermedad
|
| 80 |
Puede desempeñar actividad normal, con esfuerzo, síntomas
y signos de enfermedad más acentuados |
| 70 |
Capaz de autocuidado, pero incapaz de trabajar y/o desempeñar
actividad física normal |
| 60 |
Necesita ayuda ocasional, siendo capaz de autocuidarse la
mayor parte del tiempo |
| 50 |
Requiere de ayuda la mayor parte del tiempo y de control médico
frecuente |
| 40 |
Inválido, necesita de cuidados especiales en su domicilio |
| 30 |
Mayor invalidez, requiere hospitalización, aun cuando
no esté próximo a morir |
| 20 |
Muy enfermo, hospitalizado y dependiente de terapias de apoyo |
| 10 |
Moribundo |
Los resultados de esta evaluación tienen
alta prioridad en las decisiones terapéuticas, ya que los
pacientes en etapas I y II con baja capacidad funcional global suelen
presentar mayor extensión de la enfermedad que la revelada
por la etapificación.
En los pacientes en etapa III, existe controversia
en cuanto a la aplicación de resecciones ampliadas que incluyan
las áreas vecinas infiltradas. La excepción la constituye
el tumor de Pancoast, que es con frecuencia resecable junto con
trozo de parrilla costal.
El mejor pronóstico se observa cuando el
problema se puede solucionar con una lobectomía simple. Enfermos
en etapa I con un CNCP de alrededor de 1 cm, asintomáticos
y sin ganglios, tienen sobrevidas de hasta 80% a 5 años.
En cambio, si el tumor es grande o hay ganglios hiliares, la sobrevida
cae a un 10 a 20%. Esta diferencia en sobrevida se debe tanto a
la presencia de tumor residual como a la de metástasis ocultas.
Exámenes postmortem en pacientes que fallecen precozmente
luego de resecciones quirúrgicas aparentemente satisfactorias
demuestran enfermedad residual en el 30% y metástasis ocultas
en el 50% de los casos.
Radioterapia
Esta forma de tratamiento se utiliza con propósitos
curativos o paliativos. Se usa como tratamiento único y con
intención curativa en pacientes inoperables por otras razones
médicas y es el tratamiento de elección en el CNCP
localmente avanzado. La sobrevida en estos casos es de alrededor
de 20% a 3 años. También se emplea como complemento
de la cirugía, ya sea para reducir la infiltración
local por el tumor y mejorar la resecabilidad, como en tumores del
sulcus superior, o cuando en el acto quirúrgico se detectan
ganglios mediastínicos. Si bien la irradiación postoperatoria
reduce la recidiva local en los pacientes con ganglios mediastínicos
ipsilaterales o subcarinales, no modifica significativamente su
sobrevida, pues la mayoría de los pacientes en esta etapa
terminan presentando metástasis a distancia.
En el CCP la radioterapia se emplea en combinación
con la quimioterapia. Tanto en el CCP como en los otros tipos histológicos,
puede irradiarse preventivamente el cerebro en pacientes con un
control local y regional adecuado. Ello reduce la incidencia de
metástasis cerebrales precoces o retarda su aparición,
aunque no se ha demostrado que aumente la sobrevida.
Otra indicación de la radioterapia es en
el tratamiento paliativo en casos de obstrucción bronquial
con atelectasia o neumonitis obstructiva, hemoptisis, metástasis
cerebrales, síndrome de vena cava superior y metástasis
óseas dolorosas.
La radioterapia suele acompañarse de complicaciones
precoces, como esofagitis, que puede presentarse durante o poco
después de terminada la radioterapia, y tardías como
la neumonitis actínica, con fibrosis pulmonar secundaria
cuyos síntomas se inician meses después.
Quimioterapia
La quimioterapia, asociada a radioterapia, constituye
el pilar del tratamiento del CCP. Con ella se pueden lograr respuestas
parciales en un 50% de los pacientes y remisiones completas en un
30%. Sin embargo, la mayoría recae luego de plazos variables,
de modo que con este tratamiento combinado la mediana de sobrevida
en aquellos con enfermedad clínicamente localizada en el
tórax es de 14 meses y en aquellos con enfermedad diseminada
de 10 meses. No obstante, series recientes muestran que entre un
4 y 17% de los pacientes con enfermedad limitada al tórax
y un 1 a 3% de los pacientes con enfermedad diseminada están
vivos al cabo de 5 años de iniciada la terapia combinada.
Estos resultados, que parecen pobres, deben juzgarse teniendo presente
que la mediana de sobrevida del CCP sin tratamiento es de 3 meses.
La quimioterapia se ha visto
limitada por su efectos secundarios pero en los últimos
años se han desarrollado nuevos agentes con
acciones cada vez más especificas que han demostrado
una la mejor sobrevida, con la ventaja de que pueden ser administrados
en el paciente ambulatorio, con menos efectos secundarios y con
mejor calidad de vida.
Tratamientos sintomáticos y paliativos
El manejo de estos pacientes debe considerar el
impacto del cáncer y el de su tratamiento en la calidad de
vida del enfermo. Al respecto es conveniente distinguir:
a) Aspectos biológicos: síntomas
de la enfermedad y efectos colaterales del tratamiento, estado
físico general, autosuficiencia.
b) Aspectos psicológicos: impacto del
diagnóstico y capacidad de sobreponerse.
c) Aspectos sociales: efecto sobre relaciones
familiares o de trabajo y repercusión previsional.
La meta del tratamiento debe ser lograr la extirpación
o remisión completa del tumor y prolongar lo más posible
el período libre de enfermedad y la sobrevida. Aun cuando
el tumor no sea curable, la calidad de vida del enfermo puede ser
considerablemente mejorada por una atención minuciosa a todos
los detalles de su cuadro global. En este sentido, debe contemplarse:
a) Mejorar el estado general a través
de régimen alimentario, anabólicos, transfusiones,
etc.
b) Apoyo psicológico: puede efectuarse
psicoterapia, indicarse tranquilizantes y/o antidepresivos, adecuar
la forma de vida a la condición física del paciente,
apoyar en el enfrentamiento del diagnóstico, etc.
c) Tratamiento sintomático del dolor (analgesia
progresiva, radioterapia paliativa), de la tos (antitusivos),
de la disnea (broncodilatadores, drenaje de derrames, oxigenoterapia,
etc.).
d ) Tratamiento de las complicaciones: infección,
derrame pleural, etc.
e) Tratamiento de síndromes paraneoplásicos:
hipercalcemia, hiponatremia, artralgias, etc.
f) Tratamiento de la obstrucción bronquial
por tumor endoluminal, sea mediante alcoholización local
o rayos láser por vía endoscópica o mediante
radioterapia.
|
De todo lo expuesto se deduce que el clínico general
tiene un rol fundamental en la prevención
y detección oportuna del cáncer
bronquial, pero que su manejo es de tal complejidad que exige
la participación de varios especialistas. |
|
