|
|
|
Introducción |
| |
La pleura
puede ser afectada por diversas enfermedades, sea que la comprometan
en forma directa o que afecten su intercambio líquido indirectamente
por trastornos del equilibrio hídrico. Su compromiso es
generalmente detectado por el clínico general y varias
de sus enfermedades caen dentro de su campo de competencia.
Con frecuencia el compromiso pleural pasa inadvertido, dejando
como testimonio áreas localizadas de fibrosis o paquipleuritis
que constituyen hallazgos radiográficos o de autopsia.
Si el compromiso pleural es de suficiente magnitud, sus principales
síntomas y signos son:
Dolor pleural.
Puede ser del tipo de puntada de costado, pero puede ser sordo
o faltar. Se debe a la irritación de la pleura parietal,
inervada por los nervios intercostales. Generalmente el paciente
lo localiza en la pared costal sobre la zona comprometida,
excepto en el caso de la pleura diafragmática, en el
cual el dolor se refiere al hombro por irritación del
nervio frénico. Ocasionalmente, la irritación
de los nervios intercostales bajos produce un dolor referido
al abdomen .
Tos
seca. Se debe a la irritación de terminaciones nerviosas
de la pleura y, salvo enfermedad bronquial o alveolar concomitante,
no se acompaña de expectoración.
Disnea.
No es constante y depende de la cantidad de derrame y del estado
previo del pulmón. Se presenta generalmente en relación
a esfuerzos. aunque en derrames de gran volumen puede ser de
reposo
Antecedentes. Es importante indagar sobre exposiciones
laborales, especialmente a asbestos, y uso de medicamentos que
pueden constituir agentes causales de derrame.
Frotes pleurales. Se originan
en el roce de las pleuras deslustradas por fibrina y desaparecen
cuando las hojas se separan por interposición de líquido.
Cambios de espacios intercostales
: pueden estar protruidos en derrames muy abundantes o deprimidos
si la presión intratorácica es muy negativa
por atelectasia del pulmón subyacente
Síndrome
de derrame pleural : matidez con curva de Damoisseu y abolición
del murmullo pulmonar
Síndrome
de neumotórax: hipersonoridad con atenuación
o abolición del murmulla pulmonar
CAPITULO 49
DERRAME PLEURAL
En 1852
Laennec escribió que "las afecciones de la pleura consisten
casi siempre en alteraciones diversas de la serosidad que ella
secreta en el estado normal". Esta observación sigue
siendo cierta, ya que el derrame pleural es la principal manifestación
de las enfermedades de la pleura. El líquido que ocupa
el espacio pleural o derrame puede ser de diversa naturaleza
y la mayoría de las veces corresponde al clínico
general iniciar su estudio.
Transudado. Es el líquido
que se forma por incremento de la ultrafiltración al
nivel capilar, debido a un aumento de la presión hidrostática,
una disminución de la presión coloido-osmótica
intracapilar o una presión intrapleural exageradamente
negativa. Se caracteriza por tener una concentración
de proteínas considerablemente menor que la del plasma)
y por carecer de indicadores de inflamación. Su presencia
indica que el derrame se debe a una alteración hidrostática
por una enfermedad que no reside en la pleura que , en sí
misma, se encuentra indemne.
Exudado. Es el líquido
resultante de una lesión pleural con aumento de la
permeabilidad capilar, que permite la salida de proteínas
sanguíneas al líquido pleural . Usualmente presenta
indicadores de inflamación
Sangre. Proviene de la ruptura
de vasos sanguíneos de la pleura. La acumulación
de sangre en el espacio pleural se denomina hemotórax.
Quilo. La acumulación
de quilo en la pleura se debe a lesiones del conducto torácico
por trauma o infiltración tumoral y se denomina quilotórax.
MECANISMOS Y CAUSAS DEL
DERRAME PLEURAL
Los mecanismos responsables de la acumulación
de líquido en el espacio pleural pueden ser los siguientes:
a) Aumento de la presión hidrostática en la microvasculatura
pleural.
b) Disminución de la
presión oncótica intravascular.
c) Aumento de la negatividad
de la presión intrapleural.
d) Aumento de la permeabilidad
capilar con salida de líquido y proteínas.
e) Obstáculo al drenaje
linfático por bloqueo a nivel de los estomas parietales
o de los ganglios mediastínicos.
f) Paso de transudado peritoneal
(ascitis) a través de linfáticos o de pequeños
orificios del diafragma.
g) Ruptura de vasos sanguíneos
o del conducto torácico.
Es posible que dos o más de estos mecanismos se asocien en
la génesis de un derrame.
En la tabla 49-1 se anotan enfermedades
de la pleura y de otros órganos que conducen a derrame pleural.
Aunque no es exhaustiva puede apreciarse el alto número
de diagnósticos que pueden barajarse ante un derrame pleural
, pero debe tenerse presente que en muchas de ellas el derrame
no significa mayor problema y no exige entrar a un diagnóstico
diferencial amplio. En cambio, en otras etiologías que son
la materia de este y el próximo capítulo, el derrame
es el eje del cuadro clínico por su cuantía, sus síntomas
o su significación y exige una identificación etiológica
.
Tabla 49-1
CAUSAS DE DERRAME PLEURAL
|
| TRANSUDADOS |
AUMENTO DE LA
PRESION CAPILAR
Insuficiencia cardíaca congestiva *
DISMINUCION DE
LA PRESION ONCOTICA
Síndrome nefrótico
PASO DE TRANSUDADO
O LIQUIDO PERITONEAL
Cirrosis hepática con ascitis*
Diálisis peritoneal
MECANISMOS NO
PRECISADOS
Embolia
Sarcoidosis
Mixedema
|
| EXUDADOS
|
A.- INFECCIONES
Infecciones bacterianas*
Tuberculosis*
Virus
Hongos
Parásitos
B.- NEOPLASIAS
Propagación directa y/o metástasis*
Mesotelioma
Sarcoma de Kaposi en SIDA
C.- EMBOLIA PULMONAR*
D.- EXTENSION DE ENFERMEDADES DEL APARATO DIGESTIVO
Pancreatitis
Absceso subfrénico
Absceso hepático
Perforación esofágica
E.-ENFERMEDADES COLAGENO-VASCULARES
Artritis reumatoidea
Lupus eritematoso diseminado
F.- DROGAS
Derrame aislado o asociado a neumonitis:(nitrofurantoína,
antineoplásicos, metisergida, etc.)
Manifestación de lupus inducido por drogas
G.- EXUDADOS MISCELANEOS
Síndrome post pericardiotomía o postinfarto
(Síndrome de Dressler)
Asbestosis
Uremia
Pulmón inexpansible
Síndrome de Meiggs
Síndrome de uñas amarillas
Sarcoidosis
Radioterapia
Iatrogenia: catéter subclavio mal colocado
H.- HEMOTORAX
I.- QUILOTORAX
|
| * El asterisco indica
las causas más frecuentes |
CONSECUENCIAS FUNCIONALES
Dado que la mayoría de
las veces el derrame es manifestación de una enfermedad pulmonar
o de una insuficiencia cardíaca es difícil diferenciar
las alteraciones funcionales propias de la pleura y, además,
estas son muy variables. Lo mas corrientes es una limitación
de tipo restrictivo en la cual pueden intervenir varios factores:
a.- Dolor pleural que interfiere
con los movimientos respiratorios.
b.- El volumen líquido
disminuye el espacio para el pulmón que se retrae o
es comprimido. lo que, por no afectar en igual grado a alvéolos
y vasos, conduce a trastornos  /Q
que pueden provocar hipoxemia /Q
que pueden provocar hipoxemia
c-.El peso del liquido en derrames
importantes puede aplanar la cúpula diafragmática
correspondiente e,incluso invertir su curvatura.
d.- El aumento de tamaño
del hemitórax pone en desventaja acorta los músculos
inspiratorios con la consiguiente desventaja mecánica.
EXAMEN FISICO
Para comprender los signos físicos y
radiográficos de derrame pleural, es preciso considerar los
factores que determinan cómo se acumula y distribuye el líquido
en el tórax:
a) A
medida que se acumula líquido en el espacio pleural,
la presión negativa intratorácica disminuye
y el volumen del pulmón se reduce por efecto de su
retracción elástica, conservándose aproximadamente
su forma. El líquido va formando un manto envolvente
que alcanza su mayor grosor en la zona axilar y el menor en
la cara mediastínica (Figura 49-1).

Figura
49-1. Distribución espacial del líquido
pleural en posición de pies. El límite
superior del derrame es en realidad horizontal como
se representa en el esquema a la izquierda, pero en
la radiografía aparece como si fuera cóncavo
con su parte más alta en la pared lateral (derecha).
Un corte horizontal en la parte alta del derrame, a
nivel de la línea a-b, demostraría que
la distribución del líquido en el plano
horizontal no es homogénea (esquema central),
constituyendo una capa más gruesa en la zona
lateral porque el pulmón se colapsa más
fácilmente en sentido transversal. Los rayos
anteroposteriores que pasan por la línea c-d
y sus vecindades sólo deben atravesar las delgadas
capas de líquido en las caras anterior y posterior
del tórax, generando una opacidad poco perceptible.
En cambio, los rayos que pasan por la línea e-f
deben atravesar varios centímetros de líquido,
produciendo una sombra densa hacia la pared lateral.
Lo expuesto también explica que a la percusión
la matidez sea más alta en la zona axilar que
las frontal y dorsal (curva de Damoisseau).
b) El
líquido se acumula de acuerdo a la fuerza de gravedad,
variando su distribución según la posición
del cuerpo. En posición erecta, el líquido empieza
por acumularse entre el pulmón y el diafragma, para
luego pasar a ocupar el ángulo costofrénico
posterior, que tiene la situación más baja,
seguido por el ángulo costofrénico lateral y,
finalmente, entre la cara externa del pulmón y la pared
costal. Su límite superior es horizontal pero, como
se ha explicado, parece curvo en el examen físico y
radiográfico.
c) Lo
anterior es válido para una cavidad pleural libre,
pero puede no cumplirse si hay adherencias que limiten el
desplazamiento del líquido o si existen variaciones
locales de la colapsabilidad del pulmón.
Cuando
la cantidad de líquido sobrepasa los 300 ml es posible
detectar el derrame en el examen físico. Sus signos
más característicos son la matidez y el silencio
respiratorio:
Matidez.
La percusión sobre el área de proyección
del líquido acumulado origina un sonido mate, que en
posición vertical alcanza mayor altura en la línea
axilar media, donde la capa de líquido tiene mayor
grosor (Figura 49-1). La matidez se desplaza con los cambios
de posición; si no lo hace, significa que el líquido
se encuentra encapsulado por adherencias pleurales o que la
matidez se debe a otros mecanismos. Este signo es de mediana
sensibilidad, pero su especificidad es alta.
Abolición
del murmullo pulmonar y de la transmisión de la voz.
Se deben a la interposición de líquido entre
el pulmón y la pared.
Egofonía
o voz de cabra. Su fisiopatología se explica
en el capítulo 19.
Soplo
espiratorio. El parénquima condensado
bajo el derrame puede dar origen a un soplo que se modifica
por la interposición del líquido pleural. Se
ausculta en el borde superior del derrame donde la capa de
líquido es más delgada y puede oírse
como un soplo espiratorio suave. La denominación de
soplo pleurítico se ha abandonado, porque este signo
no es exclusivo de compromiso pleural, ya que también
puede auscultarse en neumonías sin derrame.
Los
dos últimos signos son de baja sensibilidad, por lo
que no deben exigirse para realizar el diagnóstico
de derrame. En derrames de mayor cuantía, puede apreciarse
un aumento de tamaño del hemitórax y, si el
derrame es masivo, puede acompañarse de retracción
inspiratoria costal unilateral (signo de Hoover unilateral),
debido a la tracción centrípeta del hemidiafragma
aplanado por el peso del líquido.
El examen radiográfico es
de alto valor para detectar derrames pequeños, determinar
sus características morfológicas y detectar
alteraciones concomitantes del pulmón y corazón.
Si bien es posible demostrar la acumulación inicial
de derrame entre pulmón y diafragma con estudios
radiográficos dirigidos, lo corriente es que la primera
manifestación que llama la atención es la
ocupación de los ángulos costofrénicos.
Esta se evidencia primero en el ángulo costofrénico
posterior visible en la radiografía lateral (Figura
49-2), y luego se extiende al ángulo lateral en la
placa frontal (Figura 49-3).
Figura
49-2. Derrame pleural pequeño de menos
de 300 mL: sólo es detectable en radiografía
lateral como un velamiento del seno costodiafragmático
posterior, que es la parte más dependiente del
tórax. En la placa frontal el velamiento queda
oculto detrás del diafragma.
Figura
49-3. Derrame pleural sobre 300 mL. El mayor volumen
de líquido alcanza a llenar el seno costodiafragmático
lateral.
A medida
que el derrame aumenta por sobre los 300 ml, la opacidad asciende
adoptando un límite superior cóncavo que sube
hacia el borde axilar (Figura 22-16) por las razones antes
vistas. En la radiografía en decúbito dorsal
la imagen es menos clara, ya que el líquido se desplaza
hacia la pared dorsal en una capa delgada y extensa que da
un velamiento difuso y tenue.
Cuando,
además de líquido, hay aire en la pleura (hidroneumotórax),
la horizontalidad del límite superior del derrame se
aprecia claramente, por el contraste de la interfase aire-líquido
(Figura 22-17). La disposición usual descrita puede
perderse por tabicamiento de la cavidad pleural (Figura 49-4)
o por alteraciones localizadas en la consistencia del pulmón
que imponen su forma al líquido acumulado.
Figura
49-4. Derrame pleural loculado. Debido a la formación
de adherencias y tabiques pleurales se forman cámaras
aisladas que impiden que el líquido se desplace
libremente de acuerdo a la ley de gravedad.
Si la cavidad pleural se encuentra
tabicada por adherencias, el derrame puede adoptar variadas
formas que pueden dar origen a confusiones. La ecografía
es mas sensible para la pesquisa de derrames pequeños
y para determinar su localización, sirviendo de
guía para su punción. Otra variante en la
colección del líquido que puede observarse,
especialmente en insuficiencia cardíaca, es su
acumulación en las cisuras, dando imágenes
que asemejan un tumor, que desaparecen al corregirse la
congestión pulmonar causante del derrame (Figura
49-5).
Figura 49-5. Derrame intercisural.
En la placa frontal la acumulación de líquido
se ve como una sombra redondeada, confundible con un
tumor. En lateral su situación cisural es clara
y los extremos aguzados permiten identificarla como
un derrame enquistado en la cisura menor del pulmón
derecho.
Ocasionalmente y por causas desconocidas,
el derrame puede aumentar y, sin embargo, mantenerse en
situación exclusivamente infrapulmonar, dando una
falsa imagen de ascenso diafragmático. Por la forma
especial del falso borde del diafragma y por el alejamiento
de la burbuja de aire del estómago cuando el derrame
es izquierdo, es posible sospechar esta eventualidad. Para
demostrarla se recurre a la radiografía con rayo
horizontal en decúbito lateral sobre el lado afectado.
Si hay líquido, éste se desplaza hacia la
pared costal, formando una capa horizontal fácilmente
identificable (Figura 49-6). Un espesor de 10 mm significa
que la cantidad de líquido es suficiente para permitir
una punción diagnóstica. La ecografía
es especialmente útil para demostrar esta forma de
acumulación de líquido.
Figura
49-6. Derrame infrapulmonar izquierdo. En
la placa frontal se observa un aparente ascenso del
hemidiafragma izquierdo con el seno costodiafragmático
libre. Sin embargo la distancia entre el presunto
diafragma y la burbuja de aire del estómago
mayor de 2 cm hace sospechar un derrame infrapulmonar,
lo que se puede comprobar con una radiografía
en decúbito lateral izquierdo con rayos horizontales.
En esta posición el líquido se desplaza
formando una capa horizontal sobre la pared lateral
más baja.
En los derrames de gran volumen
o masivos, el mediastino se ve desplazado hacia el lado
contrario (Figura 49-7).

Figura
49-7. Derrame pleural masivo. El líquido
asciende hasta el vértice, desplazando el mediastino
hacia el lado contrario.
Si
esto no ocurre, debe pensarse en la posibilidad de una atelectasia
simultánea del mismo lado del derrame, o en rigidez
o “congelación” del mediastino por infiltración
tumoral.
Si
bien cabría esperar que una radiografía tomada
después de vaciar completamente un derrame permitiría
conocer el estado del pulmón subyacente, en la práctica
este procedimiento es de bajo rendimiento, por dificultades
en su interpretación. Con frecuencia queda líquido
retenido en las zonas donde el pulmón alterado no
expande de inmediato y no es fácil diferenciar entre
atelectasias secundarias al derrame y condensaciones preexistentes.
La tomografía axial computada
(TAC) puede dar simultáneamente información
sobre el parénquima pulmonar, pleura en sí
misma y espacio pleural, y está indicada en casos
complejos, usualmente de resorte del especialista.
EXAMENES FUNCIONALES
Por su inespecificidad no tienen
utilidad en el diagnóstico del síndrome
ni en la identificación de su etiología.
Para evaluar la gravedad funcional del cuadro se recurre
a los gases en sangre arterial que dan un balance global
más útil.
ESTUDIO DEL LIQUIDO
PLEURAL
Establecida
la existencia de un derrame, el próximo paso es obtener
una muestra del líquido por punción pleural
o toracocentesis, para identificar la etiología o
estrechar el campo de posibles causas. Cuando el diagnóstico
clínico es claro, como suele suceder en la insuficiencia
cardíaca, es posible omitir la punción y esperar
el efecto del tratamiento de la condición basal,
salvo que se sospeche otra enfermedad agregada.
Es
el procedimiento fundamental para enfrentar el estudio de
los derrames y, previo un entrenamiento supervisado, cae
en el campo del clínico general. La punción
pleural puede ser diagnóstica o terapéutica.
Su principal contraindicación es la existencia de
un déficit de coagulación, pero en caso de
necesidad puede recurrirse a una aguja fina o a corregir,
aunque sea transitoriamente, el trastorno de coagulación
si este es importante(infusión de plasma, plaquetas,
etc.). Tampoco debe puncionarse a través de una piel
infectada.
La
punción empieza con una anestesia cutánea
con aguja fina y luego paulatinamente
de las capas musculares hasta
llegar al liquido. Habitualmente
se punciona en la región dorsal a unos 10cm de la
línea media ya que es su inicio la arteria intercostal
no esta siempre protegida por el borde inferior de la costilla.
y en un espacio intercostal bajo el borde superior
de la matidez. La aguja debe deslizarse perpendicularmente
a la pared costal por sobre el borde superior de
la costilla inferior de manera de evitar los vasos intercostales
que corren adosados al borde inferior de la costilla situada
por encima (Figura 49-8).En los pacientes
ancianos hay que ser muy cuidadoso porque la arterias se
hacen sinuosas, saliendo del area protegida. Si el
derrame es pequeño o localizado, la punción
puede hacerse bajo guía de ecografía.
Figura
49-8. Punción pleural. La aguja debe
introducirse rasando el borde superior de la costilla
para evitar los vasos intercostales que corren adosados
al borde inferior. La llave de tres pasos permite
cambiar de jeringas para tomar muestras sin que entre
aire.
La toracocentesis evacuadora o
terapéutica busca aliviar la disnea disminuyendo
en forma importante el volumen del derrame. Para su realización
es conveniente usar un dispositivo que consiste en un
catéter plástico que se introduce al espacio
pleural montado sobre una aguja que actúa como
mandril, con lo que se evita el riesgo de lacerar el pulmón
al acercarse éste a la pared. No debe evacuarse
más de 1.000 ml, salvo que se mida simultáneamente
la presión intratorácica y se controle que
ésta no baje de -20 cmH2O. Si la disminución
es mayor, puede producirse un edema pulmonar por caída
excesiva de la presión intratorácica (edema
ex vacuo). En el derrame secundario a ascitis,
debe tenerse presente que se puede estar evacuando simultáneamente
el abdomen con el peligro de hipovolemia e hipoproteinemia
si se saca demasiado líquido. Después de
la evacuación de un derrame la PaO2
puede disminuir hasta en 20 mmHg, probablemente por edema
alveolar subclínico o por recuperación más
rápida de la perfusión que de la ventilación.
En los derrames pleurales en que
es necesario mantener la pleura libre de líquido
(empiemas, hemotórax, quilotórax, neoplásicos
de rápida reproducción) se deja colocada
una sonda cuyo extremo externo debe conectarse a una trampa
de agua que impida la entrada de aire (Figura 49-9). Esta
maniobra tiene mayor riesgo que punción por lo
que exige un entrenamiento previo adecuado o la asistencia
de un especialista
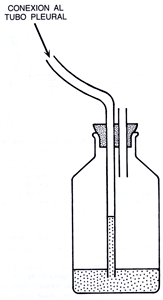
Figura
49-9. Sello o trampa de agua. El tubo que viene
de la pleura está sumergido bajo el nivel de
agua del frasco, lo que permite que salga el aire o
líquido pleural e impide que entre aire atmosférico
hacia la pleura. Durante la inspiración el agua
del frasco sube por el tubo por efecto de la presión
negativa intratorácica, por lo cual la botella
debe estar siempre unos 60 cm por debajo del nivel del
tórax.
Entre
las complicaciones de la toracocentesis cabe mencionar el
dolor por anestesia inadecuada; el neumotórax que
se evita con la correcta manipulación de agujas y
jeringas, la infección, controlable por una adecuada
asepsia y el reflejo vagal con bradicardia e hipotensión
grave. Para su prevención hace algunos años
era corriente premedicar con atropina subcutánea,
pero actualmente se prefiere tener a mano el medicamento
e inyectarlo de inmediato si se presenta algún síntoma
sospechoso. La frecuencia de las complicaciones es inversamente
proporcional a la experiencia del operador, por lo que debe
realizarse un entrenamiento supervisado antes de intentarla.
El aspecto del líquido extraído
puede dar alguna orientación diagnóstica
inmediata (Figura 49-10).

Figura 49-10.
Elementos diagnósticos macroscópicos del
líquido pleural
La mayoria
de los transudados y exudados son de color amarillento
o cetrino y transparente . Un aspecto francamente turbio
o lechoso sugiere alto contenido de células y detritus
(empiema) o de lípidos (quilotórax). Estas
condiciones pueden diferenciarse centrifugando el líquido:
en el empiema el sobrenadante es claro por sedimentación
de las células y partículas sólidas;
en cambio, en el quilotórax permanece lechoso.
Ocasionalmente se encuentran líquidos turbios que
pueden corresponder a transudados o exudados de otras
etiologías y algunos quilotorax no llegan a ser
francamente lechosos.
El
aspecto sanguinolento debe ser interpretado con cuidado,
ya que bastan 2 ml de sangre para teñir de rojo un
litro de líquido pleural. La contaminación
sanguínea producida por el trauma de la toracocentesis
puede sospecharse porque el color va aclarando a medida
que se extrae el líquido. Aunque sólo alrededor
de un 10% de los derrames neoplásicos
son hemorragicos, esta es la principal causa de ellos, siendo
seguidas por trauma, neumonía y embolía pulmonar
Cuando el aspecto hemorrágico es muy marcado, debe
centrifugarse el líquido pleural y medir el espesor
de la capa de eritrocitos precipitados (pleurocrito): se
acepta que si éste es superior a la mitad del hematocrito
sanguíneo, el derrame es un hemotórax, pero
si han pasado unos días en que se ha detenido el
sangramiento el hematocrito pleural puede bajar rápidamente
por dilución o por lisis de eritrocitos. Igualmente
si hay otros signos o circunstancias que hagan probable
un sangramiento masivo éste debe ser investigado
aunque el pleurocrito sea menor.
EXAMENES BIOQUIMICOS
DIFERENCIACION ENTRE EXUDADOS
Y TRANSUDADOS
La diferenciación entre transudado
y exudado es el primer paso del estudio químico del
líquido: si resulta un transudado, la atención
debe dirigirse a otros sistemas del organismo que pueden
alterar el equilibrio hídrico, no siendo necesario
un mayor estudio de la pleura. En cambio, si es un exudado,
la investigación debe continuar hasta identificar
la causa de la alteración de la serosa.
Proteínas.
La elevación de las proteínas pleurales
es, por definición, un marcador de permeabilidad
capilar aumentada y, por lo tanto, de exudado. Se considera
como indicadora de tal una concentración mayor que
la mitad de la del plasma. Esta forma de expresión
es preferible al uso de cifras absolutas ya que la interpretación
de éstas puede variar marcadamente según cual
sea el nivel de proteínas plasmáticas. Así,
3 g/dl de proteínas en la pleura en un sujeto con
5,5 g/dl de proteínas plasmáticas corresponden
a un exudado, mientras que el mismo valor en un paciente
con 7,5 g/dl de proteínas plasmáticas, corresponde
a un transudado.
LDH.
Otro indicador de alteración pleural es el incremento
de la lactodehidrogenasa (LDH) asociado a la acumulación
de células inflamatorias o tumorales en la pleura.
Ninguno
de los marcadores mencionados tiene sensibilidad y especificidad
absolutas, pero usados en combinación tienen un buen
rendimiento. Los criterios para su interpretación,
propuestos por Light en 1972 y reformulados en 1983, establecen
que un líquido es un exudado si presenta una o más
de las siguientes características:
-
Relación
entre proteínas del líquido y proteínas
del plasma superior a 0,5
-
Relación
entre LDH del líquido y LDH del plasma superior
a 0,6
-
Concentración
de LDH pleural sobre 2/3 del límite superior
normal del suero
Por
el contrario, si el líquido no presenta ninguna de
estas alteraciones es un transudado. Estos criterios identifican
correctamente a los exudados en un 98-99% de los casos en
los estudios originales, pero cerca de un 20% de los transudados
pueden ser erróneamente calificados como exudados,
lo que sucede especialmente en insuficiencia cardiacas tratadas
con diuréticos . En estas condiciones se concentra
el líquido pleural por salida preferente de agua.
Al
aplicar estos criterios debe tenerse presente que el límite
superior normal del suero (LSNS) varía ampliamente
según el método de medición empleado
y la edad y sexo del paciente. Esto significa que laboratorio
debe informar cual es su LNNS para la edad y sexo del paciente.
Si no es así el médico tratante debe exigir
esos datos. En el laboratorio de la Universidad Católica,
por ejemplo, el límite superior normal del suero
para un hombre adulto es de 225, de manera que el punto
de corte para ese paciente es de 150 U/L. La diferencia
por sexo es poca, pero en niños la LDH normal en
la sangre es considerablemente más alta
Es
importante tener presente que, no siendo la sensibilidad
y especificidad de 100%, cabe la posibilidad de falsos diagnósticos,
de manera que si los resultados son discordantes con el
cuadro clínico debe recurrirse a la repetición
del estudio, al uso de otros índices o a interpretar
los resultados utilizando los cuocientes de probabilidad
calculados para diferentes niveles de los resultados, en
lugar de usar un punto de corte único.
La
LDH es también un buen indicador de la intensidad
de la infiltración celular, de manera que su medición
seriada permite evaluar la evolución de la
inflamación pleural.
Colesterol. Dado que otros
investigadores usando los criterios de Light han obtenido
con rendimientos inferiores, se han estudiado diversos
indicadores, entre los cuales destaca la concentración
de colesterol, que también dependería de
la permeabilidad capilar. Por sobre 45 mg/dl indica que
el líquido es un exudado, y bajo este nivel, un
transudado. Usado aisladamente su sensibilidad es muy
satisfactoria, pero su especificidad es menor que los
criterios de Light. En nuestro Departamento hemos demostrado
que esta limitación se compensa con la consideración
simultánea de la LDH pleural: si el colesterol
está sobre 45 mg/dl o la LDH sobrepasa el 88% del
límite normal superior del suero, o sea, 200 U/L
en un adulto y con nuestro método de medición,
el líquido es un exudado. La sensibilidad de la
combinación es de 99% y la especificidad de 98%.En
el metanálisis mas amplio que se ha hecho sobre
esta materia se concluyó que esta combinación
y los criterios de Light tienen similar rendimiento.
En derrames crónicos pueden
encontrarse concentraciones muy elevadas de colesterol,
que llegan a dar al líquido un aspecto lechoso
que se diferencia del quilotórax por un bajo contenido
de triglicéridos (pseudoquilotórax).
Las limitaciones de la calificación
de resultados como positivos o negativos sobre la base
de un punto de corte único, analizada en la introducción
de Semiología, es muy evidente para los indicadores
recién vistos.
Un ejemplo puede ayudar a valorar
este aspecto: una relación pleura /suero del LDH
de 0.57 tendría que calificarse como excluyente
de exudado, lo que se aceptaría sin dificultad
si el paciente presenta signos de insuficiencia cardíaca.
En cambio, si el enfermo tiene 20 años y tiene
un cuadro febril de 20 días en una zona de alta
prevalencia de TBC, lo más probable es que se dude
del resultado excluya la probabilidad de exudado. Esto
demuestra que la probabilidad clínica previa al
examen influye sobre la interpretación de un resultado
cercano al punto de corte, hecho que puede ser cuantificado
si, en casos difíciles, se aplican los cuocientes
de probabilidad de niveles cercanos al punto de corte.
OTROS INDICADORES
Identificado el derrame como exudado
corresponde iniciar la determinación de su etiología
para lo cual se miden otros indicadores que pueden ayudar
en esta tarea.
Glucosa.
En los transudados y en muchos exudados, el nivel de
glucosa pleural se equilibra con el de la sangre, debiendo
tenerse presente que este equilibrio demora entre 60 y 90
minutos. Esto significa que después de una comida
o de una infusión de suero glucosado, los niveles
de ambos compartimentos pueden diferir importantemente.
Descartada esta eventualidad, un nivel de glucosa pleural
bajo 60 mg/dl o menor que la mitad de la glucemia puede
producirse por dos mecanismos diferentes.
-
Metabolización
de la glucosa por gérmenes, leucocitos o células
tumorales, como sucede con alta frecuencia en los empiemas
(80%) y con menor frecuencia en neoplasias (30%) y tuberculosis
(20%). En las neoplasias, una glucosa bajo 30 mg/dl
indica la presencia de gran cantidad de células
malignas, lo que se asocia a una evolución más
grave y acelerada.
-
Bloqueo
selectivo de difusión de la glucosa hacia el
espacio pleural, observado en la mayoría (85%)
de los derrames por artritis reumatoidea.
Si
la muestra no va a ser analizada de inmediato, es necesario
agregarle fluoruro de sodio para evitar la glicolisis in
vitro.
pH.
En condiciones fisiológicas el líquido
pleural tiene un pH sobre 7,50 por existir normalmente una
mayor concentración de bicarbonato en la pleura que
en la sangre. Los transudados tienen generalmente pH sobre
7,40 y la mayoría de los exudados lo tienen sobre
7,30. Cuando el pH baja de este nivel, en ausencia de acidosis
sistémica, el abanico de posibilidades etiológicas
se estrecha. En empiemas y artritis reumatoide el pH bajo
es casi constante. Se lo puede observar también en
un 30-40% de las neoplasias, 10-20% de las TBC y en un 30%
de los lupus.
El
pH resulta del balance entre la producción local
de hidrogeniones y el intercambio de iones y tampones entre
pleura y sangre. Los mayores grados de acidez se encuentran
en empiemas, en los cuales se puede alcanzar pH cercanos
a 5,00. En éstos, el principal determinante de la
acidez es la metabolización anaeróbica de
glucosa por gérmenes y leucocitos, de manera que
el grado de acidificación es índice de la
intensidad de la infección e inflamación pleural.
En
los derrames neoplásicos el determinante principal
del pH bajo es también metabólico y depende
de la masa total de células neoplásicas. Por
ello, los pacientes con líquido pleural con pH bajo
7,30 tienen una sobrevida menor, una mayor frecuencia de
citología neoplásica positiva y un peor resultado
en el sellamiento químico de las pleuras. Dada su
patogenia, en las infecciones y neoplasias la caída
del pH se acompaña de baja proporcional de la glucosa
y alza del CO2 y de
lactato.
En
la artritis reumatoidea y lupus no se ha demostrado mayor
actividad metabólica en el líquido pleural,
por lo que se ha supuesto que existe un bloqueo selectivo
a la difusión de iones y tampones.
La
muestra para la medición de pH debe tomarse en estricta
anaerobiosis y transportarse sumergida en hielo, para ser
procesada con la menor demora posible. Su análisis
debe hacerse en un equipo de medición de gases en
sangre ya que los demás sistemas son menos exactos.
Dado que este procedimiento es más complejo que la
obtención de una muestra corriente, tiene más
posibilidades de error, de manera que en caso de discordancia
clínica es conveniente repetirlo extremando las precauciones.
Lactato. La concentración
de ácido láctico es un índice directo
de metabolización anaeróbica de la glucosa
en la pleura. Su determinación permite la diferenciación
entre derrames paraneumónicos simples, en que no
hay invasión bacteriana de la pleura, y los complicados
o infectados, con gérmenes que se multiplican en
la cavidad pleural. En los primeros sólo hay una
limitada actividad metabólica de leucocitos, por
lo que el lactato no sube de 5 mMol/L. En cambio, la multiplicación
de gérmenes y actividad fagocítica leucocitaria
en los empiemas lo elevan por sobre este límite.
La sensibilidad y especificidad del lactato son similares
a las del pH para el diagnóstico de derrame pleural
complicado, pero tiene la ventaja que puede medirse en
muestras corrientes, no anaeróbicas. Este indicador
no tiene aplicación para el diagnóstico
diferencial con otras etiologías, que pueden presentar
lactato elevado o bajo, dependiendo de la celularidad
del derrame.
Adenosindeaminasa
(ADA). Es una enzima ampliamente repartida en
el organismo, que se eleva especialmente en los
linfocitos T activados. Estos se encuentran aumentados
en los derrames por TBC, artritis reumatoidea y
linfomas, de manera que los mayores incrementos
de ADA se encuentran en derrames de estas etiologías.
Por razones no precisadas, también se eleva
en algunos empiemas.
Los
criterios usados en nuestro hospital para interpretar
los resultados derivan de investigaciones locales
y son los siguientes:
-
Bajo
30 U/L: tuberculosis extremadamente improbable.
-
Entre
30 Y 80 U/L: Según la prevalencia local de tuberculosis
en diferentes países se han adoptado puntos de
corte entre 40 y 55 U/L, pero la especificidad se ve
limitada porque existen casos de neoplasia que superan
estos valores, si bien no son frecuentes. En nuestra
experiencia, la probabilidad clínica pre-test
es un determinante crítico para determinar la
significación de los niveles intermedios de ADA:
si se trata de un sujeto joven con un cuadro clínico
infeccioso, una concentración de ADA de 45 –a
50 UL se puede considerar como un apoyo suficiente como
para iniciar tratamiento, sin tener que recurrir a otros
exámenes. Al contrario, en un fumador de 60 años
en riesgo de cáncer, exigiremos un alto nivel
de ADA para inclinarnos por tuberculosis.
-
Sobre
80 U/L: las posibilidades etiológicas se reducen
a TBC, empiema, artritis reumatoidea y linfoma. Dado
que estas tres últimas entidades son, en general,
clínicamente características, un nivel
de ADA de esta magnitud permite identificar una TBC
y descartar un derrame neoplásico, que es la
principal alternativa diagnóstica en personas
mayores .
-
Cifras
extremas sobre 250 U/L se han observado solo en empiemas
y linfomas
Amilasa.
Este indicador debe solicitarse si
el cuadro clínico es sospechoso de:
a)
Pancreatitis aguda : su elevación en la pleura se
debe a la permeación del diafragma por el exudado
inflamatorio del páncreas.
Generalmente el nivel pleural de amilasa es mayor que en
el plasma que está tambien elevado.
b) Pseudoquiste pancreático:
si este se fistuliza hacia la pleura la amilasa pleural
puede llegar hasta 100.000 U/L
c)
Ruptura del esófago. En este caso la amilasa es de
origen salival El líquido está, casi invariablemente,
infectado por anaerobios, con pH muy bajo. La combinación
de amilasa alta y pH bajo 7,00 es diagnóstica de
esta condición.
Descartadas las alternativas anteriores una amilasa salival
elevada sólo en la pleura puede corresponder a un
adenocarcinoma, especialmente bronquial o del ovario. Esta
posibilidad se observa en un 10 a15% de esta neoplasias
Marcadores
inmunológicos. El único específico
es la presencia de células de lupus. El factor reumatoideo,
los anticuerpos antinucleares y los niveles de complemento
son sugerentes pero no específicos.
Triglicéridos.
Su medición está dirigida al diagnóstico
de quilotórax: sobre 110 mg/ml su especificidad es
de 99%; bajo 50 mg/ml, es sólo de 5%.
Quilomicrones. Su presencia
es 100% específica para quilotórax.
Se han estudiado una multiplicidad de otros indicadores
pero hasta el momento estos están en el área
de investigación, ya que en clínica los
que hemos analizado tiene una mejor relación costo/beneficio
Leucocitos.
Si bien algunas etiologías pueden asociarse con mayor
frecuencia a determinados recuentos totales de leucocitos,
la especificidad y sensibilidad de estas asociaciones son
bajas. En cambio, la proporción de polimorfonucleares
y linfocitos permite diferenciar entre procesos agudos y
crónicos. El predominio polimorfonuclear es característico
de los procesos agudos: derrames paraneumónicos,
embolias, pancreatitis aguda y fase inicial de una pleuresía
tuberculosa. El predominio linfocitario es característico
en los transudados y en los exudados por tuberculosis
y neoplasias de evolución crónica.
El aumento de eosinófilos
es de limitado valor diagnóstico por producirse
en múltiples condiciones,
desde neoplasia a penetracion
de aire o sangre a la cavidad pleural..
Uun
recuento sobre 100.000 eritrocitos por mm3 restringe
las posibilidades diagnósticas a neoplasia, embolia,
TBC, síndrome post-injuria cardíaca y pleuresía
por asbesto, siendo la primera la causa más frecuente.
Cantidades menores carecen de valor diagnóstico,
ya que pueden encontrarse incluso en transudados o ser
producto de la punción.
Células
mesoteliales. Es corriente encontrar células
mesoteliales libres en transudados, mientras que en los
exudados son más escasas. Se supone que esto se debería
a su destrucción por el proceso inflamatorio, o al
depósito de fibrina sobre la superficie pleural que
impide su exfoliación. Se ha dicho que un porcentaje
superior al 5% excluye tuberculosis, pero existen suficientes
excepciones como para no confiar exclusivamente en este
dato para descartar esta etiología. Un aspecto importante
de las células mesoteliales es su facilidad para
adoptar formas atípicas, especialmente en infartos
pulmonares, lo que puede llevar a falsos diagnósticos
de neoplasia si el citólogo no es experto.
Células neoplásicas.
La correcta identificación de las células
neoplásicas depende de la pericia del observador,
lo que explica que las sensibilidades comunicadas en la
literatura varíen ampliamente entre 50 y 90%. Para
evaluar este rendimiento debe tenerse presente que cabe
esperar positividad sólo cuando el derrame es producto
de la invasión tumoral directa de la pleura. No
se encontrará células malignas cuando el
derrame es consecuencia de bloqueo linfático por
metástasis mediastínicas o se debe a atelectasias
o neumonías obstructivas originadas en un cáncer
bronquial. Una segunda muestra, tomada en otro día,
aumenta levemente la sensibilidad . Suele ser útil
centrifugar el líquido pleural y examinar el block
celular resultante con técnicas histológicas
e inmunoquímicas Debe extremarse las precauciones
para evitar la formación de coágulos, que
atrapen a las células, usando 10 UI de heparina
por ml de muestra y, si estos se forman pueden ser útil
tratarlos como blocks celulares. Si bien parece razonable
suponer que la sensibilidad del examen sería
mayor a medida que aumente la cantidad de líquido
examinado, las evidencias no han demostrado esta hipótesis
y la búsqueda de estas células debe efectuarse
en todas las muestras aunque sean pequeñas
MICROBIOLOGICOS
Tinción
de Gram. Ante la posibilidad de una infección
bacteriana de la pleura, la tinción de Gram tiene
la gran ventaja de su rapidez para entregar una orientación
inicial en la elección de antibióticos. Por
no tener una alta sensibilidad, la negatividad del examen
carece de valor.
Cultivos
aerobio y anaerobio. Son de mayor sensibilidad que el
Gram y su especificidad es absoluta. Su rendimiento mejora
si se siembra la muestra de inmediato al lado de la cama
en un frasco para hemocultivos. Tienen el inconveniente
de la demora para la toma de decisiones inmediata.
Baciloscopía
y cultivo. Su especificidad es absoluta, pero su sensibilidad
es tan baja (10-20%), y los resultados del cultivo tan lentos,
que sólo excepcionalmente constituyen una ayuda útil.
En cambio, si se hace necesario llegar a una biopsia, el
cultivo de un trozo de tejido tiene una buena sensibilidad,
por lo que es conveniente hacerlo.
Biopsia
pleural por aguja. No entraremos en detalles sobre su
técnica, ya que el empleo de la aguja de Cope o de
Abrams exige un entrenamiento supervisado para asegurar
un buen rendimiento y evitar complicaciones. Su principal
indicación es la diferenciación entre TBC
y neoplasias. Aunque ocasionalmente puede dar diagnóstico
en otras enfermedades, su rendimiento es tan bajo que raramente
se justifica su empleo otros diagnósticos.
El
mejor resultado se obtiene tomando un mínimo de 4
muestras a partir del mismo sitio de punción. La
sensibilidad para neoplasia es alrededor de 60% y es menor
que la de la citología, porque el compromiso tumoral
de la pleura es irregular y el de la hoja parietal es más
tardío que el de la visceral. Para TBC la sensibilidad
es sobre 75% y sube a 90% si se añade cultivo de
una de las muestras, pero tiene el inconveniente de la demora
de su resultado. Cuando la sospecha clínica es muy
fuerte y la biopsia revela sólo cambios inespecíficos,
es conveniente el contacto directo con el patólogo
para realizar un mayor número de cortes histológicos
de la muestra. En caso de negatividad de la primera biopsia,
una segunda en otro sitio mejora importantemente estos resultados,
pero una tercera no aumenta el rendimiento. La biopsia está
contraindicada en trastornos de coagulación o cuando
existe sospecha de empiema.
Biopsia
toracoscópica. Mediante la introducción
al tórax de un endoscopio especial, es posible ver
las zonas alteradas de la pleura y tomar biopsias dirigidas,
con un rendimiento superior al de muestras tomadas a ciegas
por aguja, especialmente en lesiones neoplásicas.
Es un procedimiento de utilidad demostrada pero, por su
costo e invasividad, debe indicarse en conjunto con el especialista
en aquellos casos en que el estudio usual bien llevado no
haya dado diagnóstico.
Biopsia
quirúrgica. Con el adecuado uso de los métodos
antes analizados, la necesidad de realizar una biopsia quirúrgica
se reduce, justificándose cuando ha fracasado todo
el estudio anterior y hay necesidad de un diagnóstico
preciso. Ante la sospecha de un mesotelioma, suele ser necesario
recurrir a ella con más frecuencia, porque el diagnóstico
histológico de este tumor es difícil y necesita
de una muestra mayor que la obtenida con aguja.
Conviene
destacar que incluso después de la biopsia quirúrgica,
puede quedar un pequeño número de pacientes
sin diagnóstico, de los cuales dos tercios sanan
espontáneamente. Posiblemente parte de estos son
infecciones virales que en estudios se ha demostrado que
existen, pero son difíciles de comprobar en clínica..El
otro tercio termina por ser una neoplasia, por lo general
mesotelioma o linfoma.
En
los casos en que hay dificultades para establecer diagnóstico,
puede ser útil la medición seriada de LDH
ya que si va en disminución indica que el proceso
va a regresión, mientras que si va en ascenso justifica
insistir en exámenes más invasivos.
VINCULOS EXTRAPROGRAMATICOS
• John E. Heffner, Steven
A. Sahn, y Lee K. Brown, Multilevel Likelihood Ratios
for Identifying Exudative Pleural Effusions.
Chest,
Jun 2002; 121: 1916 - 1920.
Aplicación de cuociente de probabilidad
(likelihood ratio) a derrames pleurales.
|
|
|

