| |
FORMAS DE ADMINISTRACION
DEL OXIGENO
Existen diferentes métodos para administrar
el O2, cada uno de ellos con indicaciones más
o menos precisas y con ventajas e inconvenientes propios. La fuente
de oxígeno es variable, desde el sistema centralizado de
los hospitales hasta diferentes equipos domiciliarios.
|
Figura 59-1. Sistemas
de administración de oxígeno: balones de oxígeno
comprimido, en el extremo superior izquierdo; concentrador
de oxígeno, en el extremo superior derecho; y un
balón estacionario de oxígeno líquido
junto a un reservorio portátil (al centro, abajo).
Los objetos no están dibujados a escala. |
Los dispositivos empleados para la administración
de oxígeno se describen en la Tabla 59-1. Los más
empleados son los balones metálicos con gas comprimido que
contienen O2 al 100% a alta presión. Sin embargo,
resultan poco prácticos en aquellos pacientes que requieren
flujos altos y continuos de O2 (> 2 L/min por 24 horas),
pues obligan al recambio frecuente de los balones y aumentan, consecuentemente,
los costos de mantención. Estos inconvenientes son superados
por los concentradores eléctricos, que funcionan haciendo
pasar el aire ambiente a través de un filtro molecular que
remueve el nitrógeno, el vapor de agua y los hidrocarburos,
con lo cual concentran el O2 ambiental a más del
90%. Su uso exige una alta inversión inicial, pero permite
disminuir los costos de mantención. Debido a que emplean
energía eléctrica, se requiere algún medio
complementario de aporte de O2 para aquellas situaciones
en que se interrumpa el suministro eléctrico. Desafortunadamente,
el gas comprimido y los concentradores no permiten la deambulación
de los pacientes fuera del domicilio. Los únicos dispositivos
que lo permiten son los depósitos de oxígeno líquido,
reservorios estacionarios que permiten llenar reservorios portátiles
livianos, con autonomías de hasta 7 horas a flujos de 2 L/min.
Esto permite al paciente estar varias horas alejado de la fuente
estacionaria y eventualmente reintegrarse a alguna actividad laboral.
Tienen el inconveniente de su alto costo.
| Tabla
59-1
SISTEMAS DE ADMINISTRACION DE OXIGENO. VENTAJAS Y DESVENTAJAS |
| Sistema |
Gas |
Líquido |
Concentrador |
| Costo inicial
Costo de mantención |
Moderado
Moderado |
Alto
Alto |
Alto
Bajo |
| Portabilidad |
Uso
domiciliario |
Excelente |
Uso
domiciliario |
| Disponibilidad |
Amplia |
Limitada |
Amplia |
El O2 puede ser entregado desde la fuente
al paciente mediante sistemas de bajo o alto flujo. Los sistemas
de bajo flujo incluyen las nariceras y las mascarillas de reservorio,
mientras que las mascarillas con sistema Venturi corresponden a
sistemas de alto flujo.
Naricera o cánula vestibular binasal.
Por introducirse sólo en los vestíbulos nasales aprovecha
la función acondicionadora del aire que presta la nariz,
pero no permite conocer exactamente la fracción inspirada
de oxígeno (FIO2) por el agregado de diferentes
cantidades de aire ambiente. En pacientes estables, una aproximación
útil es que 1 L/min aumenta la FIO2 a 24%, 2 L/min
a 28%, 3 L/min a 32% y 4 L/min a 35%. Puede emplearse aún
si la respiración del paciente es predominantemente oral,
pues se ha demostrado que una cantidad pequeña pero suficiente
de O2 logra entrar al aparato respiratorio. Es el método
más utilizado para administrar oxígeno suplementario
cuando la hipoxemia es de poca magnitud.
Actualmente existen diversos sistemas ahorradores
de O2, que tienen como objetivo mejorar la eficiencia
de la administración de oxígeno, reduciendo su pérdida
durante la espiración, con lo que disminuye el costo en un
25-50%. Unos poseen un reservorio que acumula oxígeno durante
la espiración. Otros son capaces de detectar las presiones
respiratorias, activándose sólo durante la inspiración.
Mascarillas de reservorio. En estas
mascarillas existe un reservorio que acumula oxígeno en cantidad
suficiente para permitir el flujo inspiratorio que la
demanda ventilatoria del paciente requiera. La mascarilla de reservorio
más usada posee tres válvulas de una vía
que impiden la recirculación del gas espirado: una ubicada
entre el reservorio y la mascarilla, que permite que pase O2
desde el reservorio durante la inspiración, pero impide
que el gas espirado se mezcle con el O2 del reservorio
en la espiración; las otras dos, localizadas a
cada lado de la mascarilla, permiten la salida del
gas exhalado al ambiente durante la espiración, a la vez
que impiden que ingrese aire ambiental en la inspiración
que podría reducir la FIO2. Estas mascarillas se
emplean en la insuficiencia respiratoria hipoxémica porque
permiten el aporte de altas concentraciones de O2,
pero son claramente inapropiadas en pacientes hipercápnicos,
que se agravan con la administración excesiva de O2.
Mascarillas con sistema Venturi.
Son incómodas, pero tienen la ventaja de asegurar una FIO2
constante, tanto si varía la ventilación del paciente
o si su respiración es oral. Estas mascarillas entregan un
flujo alto de gas con concentraciones regulables de oxígeno
que permiten FIO2 entre 24-50% (Figura 59-2). Cuando
el oxígeno pasa a través del estrecho orificio de
entrada aumenta su velocidad y arrastra aire de las portezuelas
laterales. La cantidad de aire que entre a la mascarilla dependerá
del flujo de O2 y de la apertura de las portezuelas,
y determinará la fracción inspirada de oxígeno.
Esta mezcla aire-O2 alcanza un flujo aproximado de 40
L/min y es suficiente para satisfacer las demandas ventilatorias
de la mayoría de los pacientes con insuficiencia respiratoria
aguda, por lo que la FIO2 es bastante estable. Si el
flujo fuese excesivo, escapa por aberturas localizadas a cada lado
de la mascarilla. En raras ocasiones en que la demanda ventilatoria
sea mayor a 40 L/min, el paciente puede tomar aire del ambiente
a través de estas aberturas y la FIO2 se hace
menos estable. Las mascarillas con sistema Venturi se emplean corrientemente
en dos situaciones:
- Cuando la hipoxemia es de riesgo y se requieren concentraciones
altas y estables de O2 en forma que permiten seguir
el curso de la insuficiencia respiratoria a través de
la relación entre la FIO2 y la PaO2.
- Cuando existe retención de CO2 en una insuficiencia
respiratoria aguda sobre crónica y debe administrarse
oxígeno en concentraciones precisas y progresivas, aspecto
que se discutirá más adelante.
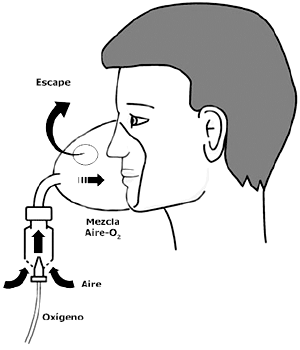 |
Figura 59-2. Mascarilla
con sistema de Venturi. El oxígeno entra a la
mascarilla por un pequeño orificio a alta velocidad,
arrastrando aire de las portezuelas laterales. La mezcla
final alcanza un flujo ~ 40 L/min, que si es excesivo
se elimina por las aberturas laterales de la mascarilla. |
SISTEMAS DE HUMIDIFICACION DEL OXIGENO
El oxígeno proporcionado por los diferentes
métodos es seco, de manera que es conveniente agregar vapor
de agua antes de que se ponga en contacto con las vías aéreas,
para evitar la desecación de éstas y de las secreciones.
La necesidad de humidificación es muy crítica cuando
el flujo de gas proporcionado es mayor de 5 L/min y cuando se han
excluido los sistemas naturales de acondicionamiento del aire inspirado,
como sucede en los pacientes intubados. Los humidificadores disponibles
en nuestro medio para la terapia con oxígeno son básicamente:
Humidificadores de burbuja. En
estos sistemas, la humidificación se logra pasando el gas
a través de agua. Al formarse de esta manera múltiples
burbujas, aumenta exponencialmente la interfase aire-líquido
y, por lo tanto, la evaporación. Estos son los humidificadores
de uso corriente con las nariceras y mascarillas de alto flujo.
Humidificadores de cascada. Calientan
concomitantemente el agua, incrementando la evaporación.
Se utilizan preferentemente para la humidificación de gases
administrados a alto flujo, especialmente en ventiladores mecánicos.
RIESGOS DE LA ADMINISTRACION DE OXIGENO
En la terapia con oxígeno existe la posibilidad
de reacciones adversas funcionales y por daño celular. Dentro
de las primeras se encuentra el aumento del cortocircuito pulmonar
debido a atelectasias por reabsorción y la acentuación
de una hipercapnia previa. Las lesiones por daño celular
incluyen tanto lesiones de las vías aéreas como del
parénquima pulmonar y corresponden a lo que usualmente se
conoce como "toxicidad por oxígeno".
Atelectasias por reabsorción.
Al emplear altas concentraciones de oxígeno, éste
puede reemplazar completamente al nitrógeno del alvéolo,
lo que puede causar atelectasias por reabsorción si el oxígeno
difunde desde el alvéolo a los capilares más rápidamente
de lo que ingresa al alvéolo en cada inspiración.
Es más probable que esto ocurra en zonas con relaciones  /Q
bajas, porque está limitada la velocidad de llenado del alvéolo
y cuando aumenta el consumo de oxígeno, porque se acelera
la salida de O2 desde el alvéolo. /Q
bajas, porque está limitada la velocidad de llenado del alvéolo
y cuando aumenta el consumo de oxígeno, porque se acelera
la salida de O2 desde el alvéolo.
Acentuación de hipercapnia. La
hipercapnia agravada por la hiperoxia generalmente se produce por
una combinación de tres fenómenos: aumento del espacio
muerto, efecto Haldane y disminución de la ventilación
minuto:
- El aumento del espacio muerto se debe a la redistribución
del flujo sanguíneo que provoca la administración
de oxígeno en pacientes en los que coexisten áreas
pulmonares con relaciones V/Q bajas y elevadas, siendo la EPOC
el ejemplo más característico. Normalmente en
los alvéolos mal ventilados se produce una vasoconstricción
hipóxica que disminuye la perfusión de esos alvéolos,
lo que constituye un fenómeno compensatorio que deriva
el flujo sanguíneo hacia los territorios mejor ventilados.
Al aumentar la FIO2 aumenta el oxígeno alveolar
y cesa la vasoconstricción compensatoria, aumentando
la perfusión sin que mejore la ventilación. Como
consecuencia de ello la sangre venosa no puede eliminar suficientemente
el CO2 que trae, lo que incrementa la PaCO2
de la sangre arterializada.
-
El efecto Haldane consiste en la disminución
de la afinidad de la hemoglobina para el CO2 cuando
se oxigena, provocando un aumento del CO2 disuelto
en la sangre a la par que se reduce la ventilación minuto
por disminución del estímulo hipóxico en
los quimiorreceptores periféricos. Este mecanismo juega
un rol menor, comparado con los dos anteriores.
Algunos de estos pacientes presentan un aumento
progresivo de la PaCO2, llegando a la llamada "narcosis
por CO2" probablemente debido a que los efectos
ansiolíticos y antidisneicos del oxígeno pueden
ser suficientes para inducir sueño en pacientes deprivados
de sueño por la insuficiencia respiratoria aguda durante
el sueño disminuye la respuesta ventilatoria a la hipercapnia
y, como la hiperoxia disminuye el estímulo hipóxico
periférico, el resultado final es una hipoventilación
alveolar e hipercapnia progresivas.
Cuando, por las características del paciente,
existe el riesgo de que se produzca hipercapnia agravada por oxígeno,
debe recurrirse a la oxigenoterapia controlada. Esta técnica
se basa en que, en una hipoxemia grave, la PaO2
se ubica en la parte vertical de la curva de disociación
de la hemoglobina, de manera que basta un leve aumento de PaO2
para que el contenido y saturación se eleven lo suficiente
como para sacar al paciente del área de mayor riesgo. Un
resultado de esta magnitud se puede lograr aumentando la concentración
de O2 inspirado a 24-28%, con una mascarilla con sistema
Venturi. Estas concentraciones no anulan totalmente la vasoconstricción
hipóxica y tampoco removerían el estímulo hipóxico
del seno carotídeo. De acuerdo a la respuesta observada en
los gases arteriales, controlados 30 minutos después de cada
cambio, la FIO2 se aumenta gradualmente hasta obtener
una PaO2 sobre
55-60 mmHg, o a aquélla en que no se produzca un alza exagerada
de la PaCO2. Si no se alcanzan estas condiciones, deberá
considerarse el uso de ventilación mecánica. Si no
se cuenta con mascarillas con sistema de Venturi, puede usarse nariceras,
con flujos iniciales de 0,25 a 0,5 L/min.
Daño de la vía aérea.
Cuando se hace respirar oxígeno puro a voluntarios sanos,
éstos pueden experimentar tos y disnea dentro de las primeras
24 horas de su administración. Tales síntomas se han
atribuido a una inflamación traqueobronquial, la que se ha
demostrado mediante fibrobroncoscopia ya a las 6 horas de exposición.
El daño de la mucosa se debe probablemente a la generación
de especies reactivas de oxígeno (anión súper
óxido, radicales hidroxilos, peróxido de hidrógeno,
entre otros), que se ha observado que aumentan precozmente en el
aire exhalado en condiciones de hiperoxia.
Daño del parénquima pulmonar.
En pacientes con síndrome de distrés respiratorio
agudo no ha sido posible establecer si el uso de concentraciones
elevadas de oxígeno aumenta la magnitud del daño pulmonar.
Sólo existe un estudio retrospectivo en sobrevivientes al
síndrome, en quienes se observó que haber recibido
una FIO2 > 0,6 por más de 24 horas se asociaba
a un mayor daño pulmonar residual al año. Los resultados
de otros estudios realizados en pacientes sin daño pulmonar
previo han proporcionado resultados no concluyentes. La escasa información
disponible sugiere evitar el uso de FIO2 > 0,60 y
si esto no es posible, usarlas por el menor tiempo que sea necesario.
Existen otras situaciones en que el empleo
de oxígeno podría potenciar el daño pulmonar
inducido por otros agentes como bleomicina, amiodarona y radioterapia.
INDICACIONES DE OXIGENOTERAPIA
La oxigenoterapia tiene indicaciones para su empleo
en situaciones agudas y crónicas. Por situaciones agudas
nos referimos a emergencias médicas donde se produce hipoxemia
por insuficiencia respiratoria (ver Capítulo 54) o donde,
en ausencia de hipoxemia, se requiere asegurar una apropiada entrega
tisular de oxígeno, como en el shock de cualquier causa,
infarto del miocardio, accidente vascular cerebral, etc.
En el presente capítulo sólo nos
referiremos brevemente al uso crónico de oxígeno,
que ya ha sido tratado en el Capítulo 36. La oxigenoterapia
crónica tiene indicaciones muy precisas, debido a su alto
costo. Su efecto beneficioso más relevante es prolongar la
sobrevida. Sin embargo, este efecto sólo se ha demostrado
en pacientes con EPOC. En las otras causas de insuficiencia respiratoria
crónica en que se emplea O2 (enfermedades intersticiales,
enfermedades neuromusculares, otras limitaciones crónicas
del flujo aéreo) los efectos benéficos son principalmente
sintomáticos: disminución de la disnea, aumento de
la capacidad de ejercicio, mejoría de la calidad del sueño
y mayor calidad de vida. Los criterios empleados para indicar el
uso crónico continuo de oxígeno son más o menos
universales (Tabla 59-2).
| Tabla
59-2
INDICACIONES DE OXIGENOTERAPIA CRONICA |
| Oxigenoterapia continua
(18-24 h/día) |
|
PaO2 < 55 mmHg en reposo
PaO2 56-59 en reposo si hay:
Edema sugerente de insuficiencia cardíaca
P pulmonar en ECG (P > 3 mm en
DII, DIII o aVF)
Poliglobulia (Hcto > 56%)
|
| Oxigenoterapia intermitente |
| PaO2
< 55 mmHg sólo durante ejercicio
PaO2 < 55 mmHg sólo durante el sueño |
En cambio, no existe aún consenso respecto
de su empleo intermitente, en parte porque no se ha demostrado que
este tipo de indicación modifique la evolución natural
de ninguna de las enfermedades mencionadas. Puede contribuir a la
mejoría de algunos síntomas (disnea y capacidad de
ejercicio), pero sólo en algunos pacientes. Si existe tratamiento
farmacológico para la enfermedad que ha originado la insuficiencia
respiratoria, una exigencia previa al inicio de la oxigenoterapia
es que el motivo de su indicación persista al cabo de 4 semanas
de tratamiento óptimo. |
|
