 |
||||||
Técnicas de oxigenoterapiaFuentes de oxígenoBalones a presión. Los dispositivos más comunes son los balones metálicos con gas comprimido: los cilindros más grandes contienen 9.000 litros de O2 a alta presión, con una concentración de 100%. Ellos son útiles en pacientes que requieren bajo flujo, como sucede en los pacientes con EPOC. En pacientes que requieren un flujo más alto, en cambio, resultan poco prácticos por el alto costo de su reposición y por su duración limitada. También existen balones más pequeños, que permiten el transporte y, por lo tanto, una mayor actividad de los pacientes. Concentradores. Son equipos eléctricos que funcionan haciendo pasar el aire ambiente a través de un filtro molecular, que remueve el nitrógeno y el vapor de agua. Proporcionan un gas que contiene más de 90% de O2, con flujos variables según el modelo. Su uso es restringido por exigir una alta inversión inicial, el gasto de mantención, en cambio, es relativamente bajo. Oxígeno líquido. Son reservorios de baja presión con oxígeno a baja temperatura, que contienen hasta 70.000 litros. Además, tienen la ventaja de permitir traspasar en el domicilio parte del O2 a reservorios portátiles livianos, que contienen oxígeno suficiente para 4-8 horas a 2 L/min, lo que permite al paciente estar varias horas alejado de la fuente estacionaria y eventualmente reintegrarse a alguna actividad laboral. Tiene el inconveniente de su alto costo.
|
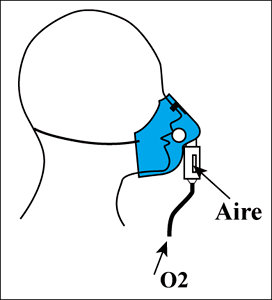 |
| Fig. 6.1 |
Otras formas de administración. En el pasado se empleó una sonda intranasal, que fue desechada por ser traumática y por ocluirse con facilidad. También es posible emplear un catéter transtraqueal, método invasivo que tiene las ventajas de poder ocultarse y de ser más eficiente en el uso del O2.
Humidificación del O2
El oxígeno proporcionado por los diferentes métodos es seco, de manera que es conveniente agregar vapor de agua antes que se ponga en contacto con las vías aéreas, para evitar la desecación de éstas y de las secreciones. La necesidad de humidificación es muy crítica cuando el flujo de gas proporcionado es mayor de superior a 5 L/min y cuando se han excluido los sistemas naturales de acondicionamiento del aire inspirado, como sucede en los pacientes intubados. Los humidificadores disponibles en nuestro medio para la terapia con oxígeno son básicamente de dos tipos:
Humidificadores. En estos sistemas, la humidificación se logra pasando el gas a través de agua. Al formarse de esta manera múltiples burbujas, aumenta exponencialmente la interfase aire-líquido y, por lo tanto, la evaporación. Los humidificadores de burbuja de uso corriente con las cánulas nasales son, sin embargo, poco eficaces en la producción de vapor y como los flujos empleados con estas cánulas son habitualmente inferiores a 5 L/min, su empleo es discutible.
Humidificadores de cascada. Calientan concomitantemente el agua, incrementando la evaporación. Se utilizan preferentemente para la humidificación de gases administrados a alto flujo, especialmente en ventiladores mecánicos.
Riesgos de la administración de oxígeno
Hipercapnia. La terapia con O2 puede provocar una elevación marcada de la PaCO2, llegando a la narcosis por CO2 en los casos graves. Los enfermos que presentan este efecto son principalmente aquellos con EPOC reagudizada, aunque ocasionalmente puede verse en otras enfermedades crónicas. Hasta hace pocos años el fenómeno se atribuía a que estos pacientes tenían su centro respiratorio insensible al CO2 y que mantenían su ventilación gracias al estímulo de los receptores carotídeos y aórticos por la hipoxemia. La corrección total de la hipoxemia dejaba, en consecuencia, al enfermo carente de estímulos ventilatorios, por lo que hipoventilaba. La constatación de que en muchos de estos pacientes el centro respiratorio respondía normal o, incluso, exageradamente al CO2, condujo a buscar otros mecanismos. Actualmente se acepta que el O2 que llega a alvéolos con mala ventilación, dilata los vasos previamente contraídos por la hipoxia alveolar, con lo que disminuye la relación V/Q de estas zonas (Figura 6.2). Con ello, aumenta la perfusión de zonas mal ventiladas (con CO2 alto), disminuyendo la perfusión de las zonas mejor ventiladas, lo que incrementa la PaCO2 arterial. Otro mecanismo tiene relación con la la afinidad de la hemoglobina para el CO2, que disminuye cuando esta se oxigena, liberándose CO2 que pasa al alvéolo donde su presión aumenta porque la ventilación es insuficiente para su remoción.
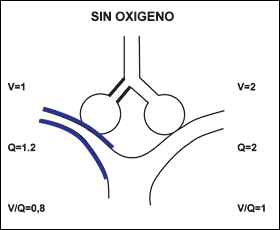 |
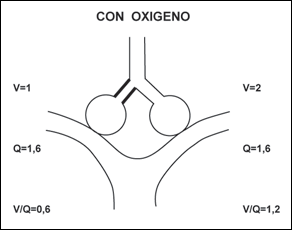 |
| Fig. 6.2 |
Cuando, por las características del paciente, existe el riesgo que se produzca este fenómeno, debe recurrirse a la oxigenoterapia controlada, generalmente en pacientes hospitalizados. Esta técnica se basa en que, en una hipoxemia grave, la PaO2 se ubica en la parte vertical de la curva de disociación de la Hb, de manera que basta un leve aumento de PaO2 para que el contenido y saturación se eleven lo suficiente como para sacar al paciente del área de mayor riesgo. Un resultado de esta magnitud se puede lograr aumentando la concentración de O2 inspirado a 24-28%, con una mascarilla. Estas concentraciones son incapaces de anular totalmente la vasoconstricción en los alvéolos mal ventilados y no significarían la remoción de un eventual estímulo hipóxico del seno carotídeo. De acuerdo a la respuesta observada en los gases arteriales, controlados 30 minutos después de cada cambio, la FIO2 se aumenta gradualmente hasta obtener una PaO2 sobre 55-60 mmHg, o a aquélla en que no se produzca un alza exagerada de la PaCO2. Si este último nivel de PaO2 es demasiado bajo, debe considerarse el uso de ventilación mecánica. Si no se cuenta con mascarillas, pueden usarse cánulas binasales, con flujos iniciales de 0,25 a 0,5 L/min.
Otras reacciones adversas. No las trataremos en profundidad, ya que ocurren con muy escasa frecuencia en pacientes con EPOC, dado que en ellos se emplean bajas concentraciones de O2. La oxigenoterapia en altas concentraciones puede producir atelectasias por absorción en alvéolos hipoventilados. Esta situación ocurre debido a que si el O2 forma una proporción muy alta del gas alveolar, las unidades alveolares pueden colapsar, ya que este gas es rápidamente absorbido por la sangre. La oxigenoterapia en altas concentraciones también puede provocar daño celular en la vía aérea y el pulmón, probablemente a través de la generación de radicales libres.
 |